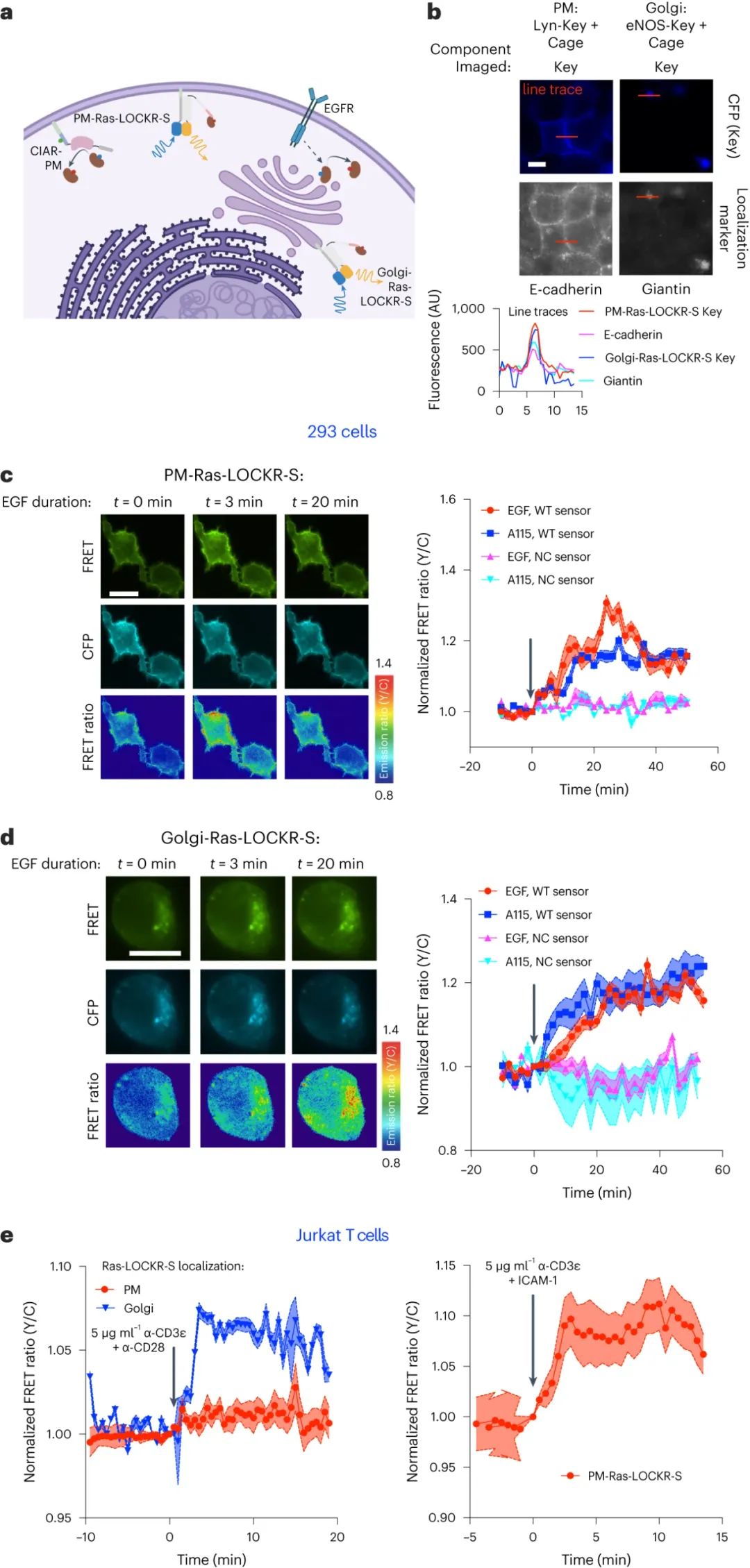
GTPase-Ras在三分之一的癌癥中發生突變�,是一種在GTP結合(活性)和GDP結合(非活性)狀態之間切換的中心信號分子。幾乎所有致癌的Ras突變都會過度激活這種蛋白質,這表明Ras的活性需要在細胞中仔細調節��。然而����,沒有傳感器可以檢測其天然細胞環境中的內源性Ras活性,這阻礙了研究人員解決Ras如何調節的基本問題的能力�。盡管已經嘗試過��,但設計內源性Ras的傳感器是困難的,因為活性Ras(Ras-GTP)的水平在納摩爾范圍內;因此����,設計響應生理相關濃度的活性Ras而切換的傳感器是具有挑戰性的����。由于傳感器設計的這一挑戰適用于許多不同的生物分子��,由于傳感器支架和設計方法的可用性有限�,為活性Ras開發的傳感器可以廣泛地為其他內源性生物分子的傳感器開發提供信息�����。為了開發內源性活性Ras的傳感器���,華盛頓大學David Baker�����、Dustin J. Maly����、Jason Z. Zhang等研究人員使用了新的傳感器支架和設計方法。對于傳感器支架���,研究人員使用了從頭蛋白質開關LOCKR(閂鎖正交籠鍵蛋白質)。LOCKR與天然蛋白質沒有序列或結構相似性�����。此外���,它的切換行為是清晰的����,并且由于它的正交性,它可以在不影響傳感器功能的情況下發生變化�����。對于設計方法��,研究人員使用基于Rosetta的蛋白質設計算法和AlphaFold結構預測來調整LOCKR的切換(從閉合的�����、自動抑制的狀態轉變為Ras-GTP依賴的開放狀態,其中讀出結構域接近)����,以匹配內源性活性Ras的生理相關濃度范圍��。利用這些策略,研究人員開發了兩種傳感器:一種是基于熒光的傳感器����,該傳感器基于距離依賴性F?rster共振能量轉移的變化來測量Ras的活性(命名為Ras-LOCKR-S)�,另一種是通過生物素化活性Ras周圍的附近蛋白質來表征Ras環境的基于分裂鄰近標記器的傳感器(命名為Ras-LOCKR-PL)�。這些傳感器足夠靈敏以檢測內源性活性Ras,與活細胞兼容以使Ras活性能夠隨時間測量���,并且可以定位于不同的細胞區室以使Ras-GTP能夠以亞細胞分辨率檢測。利用這些工具�����,研究人員探索了在肺腺癌中發現的一種微米大小的細胞內顆粒結構����,命名為EML4-ALK,它能在沒有膜的情況下激活Ras�����;鑒于典型的Ras活化需要膜��,這一觀察結果令人驚訝����。研究人員將Ras LOCKR PL工具靶向EML4-ALK顆粒����,并在其中發現了增強的生物素標記。然后���,研究人員提取出生物素標記的蛋白質,將樣品送去進行質譜分析����,并通過該分析將有絲分裂中相關的Src 68kDa(SAM68)鑒定為富含EML4-ALK顆粒的蛋白質。此外����,藥理學�、生物化學和細胞研究(包括使用Ras-LOCKR-S的研究)顯示��,SAM68在EML4-ALK顆粒中特異性地促進Ras活性�����,這表明靶向SAM68可能有利于治療EML4-ALK驅動的癌癥(例如肺腺癌),因為其對Ras的顆粒特異性激活。圖|Ras-LOCKR-S可以在多種細胞類型中報告亞細胞內源性Ras活性圖|確定EML4-Alk顆粒內致癌Ras活性的上游驅動因素綜上所述����,基于LOCKR的Ras傳感器的開發為無膜顆粒內Ras活性的調節提供了見解���。在未來��,設想這些Ras傳感器有助于回答信號和癌癥領域的其他基本問題。鑒于許多其他生理上重要的目標缺乏傳感器,希望該傳感器設計策略也將有助于為更多目標設計傳感器。盡管從紙面上看,該傳感器設計策略應該很容易適應任何目標���,但每個目標當然都有細微差別,這需要用戶的直覺。此外,盡管該設計策略有助于指導傳感器的開發���,但研究人員仍然通過實驗測試了約100種設計,以確定性能最佳的傳感器;因此���,該方法仍然需要投入大量的時間和精力。展望未來,研究人員將致力于改進該Ras傳感器��,并將其應用于回答更多的生物學問題���,例如體內腫瘤模型中內源性Ras活性是如何調節的�。此外,蛋白質設計方法的改進將擴大傳感器設計的范圍����,用于其他具有挑戰性的目標,如小分子。總的來說����,可以設想該工具和設計方法可以加速各種細胞過程的生物發現���。Zhang, J.Z., Nguyen, W.H., Greenwood, N. et al. Computationally designed sensors detect endogenous Ras activity and signaling effectors at subcellular resolution. Nat Biotechnol (2024).https://doi.org/10.1038/s41587-023-02107-w