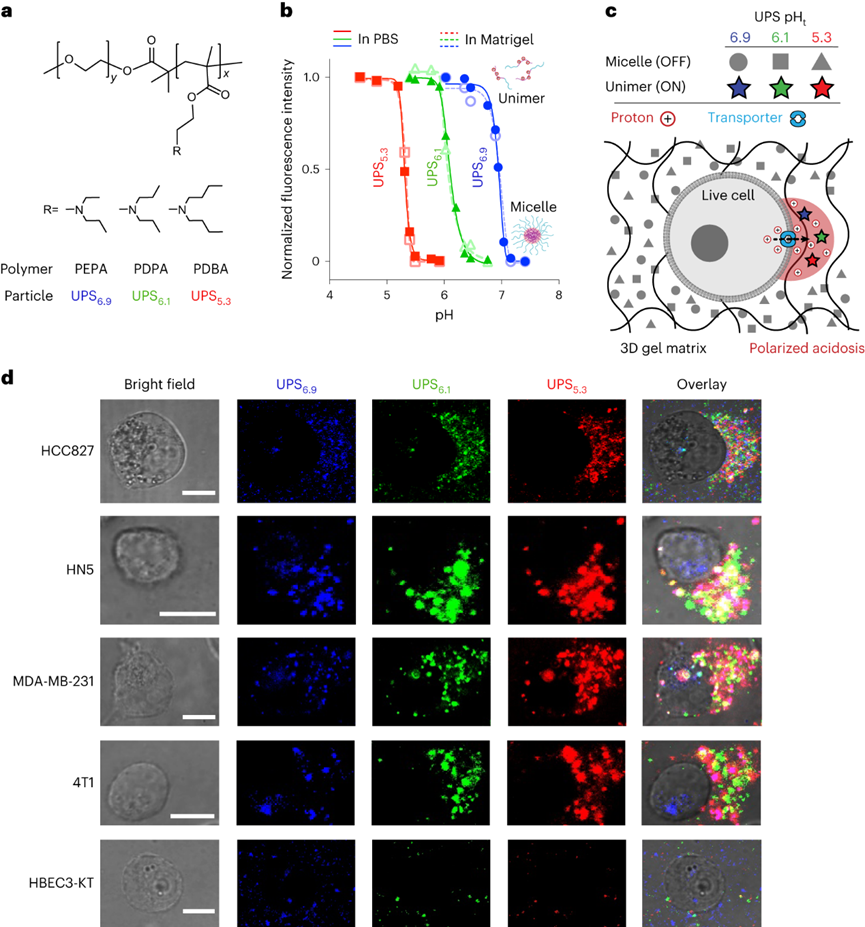
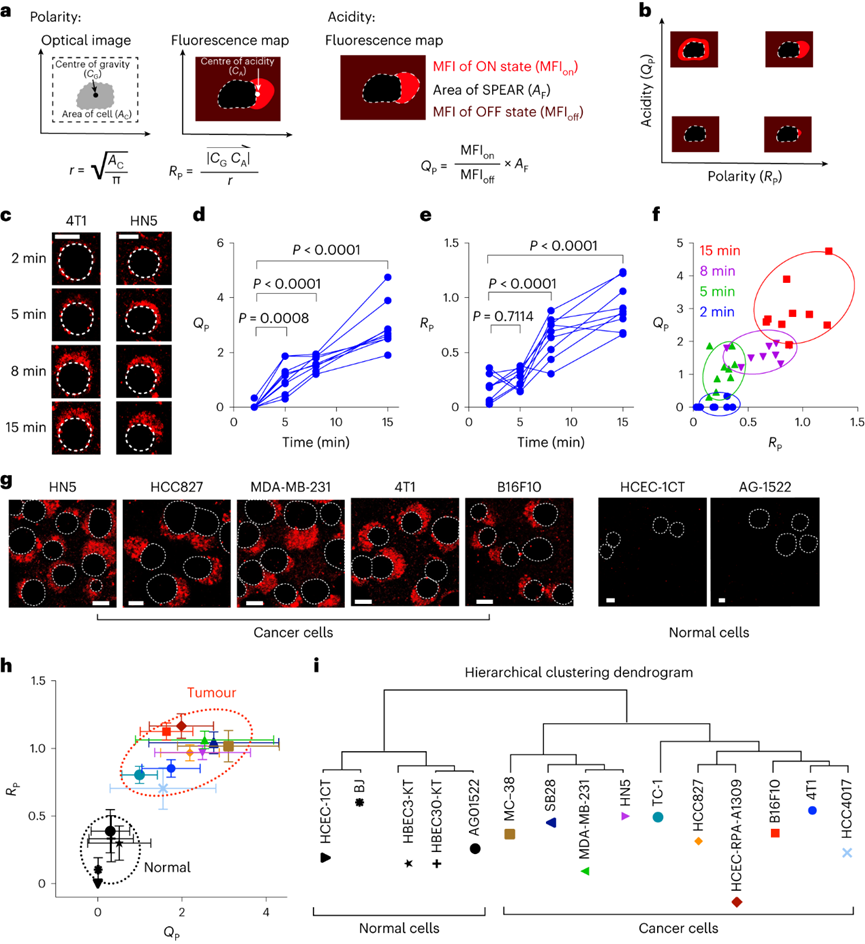
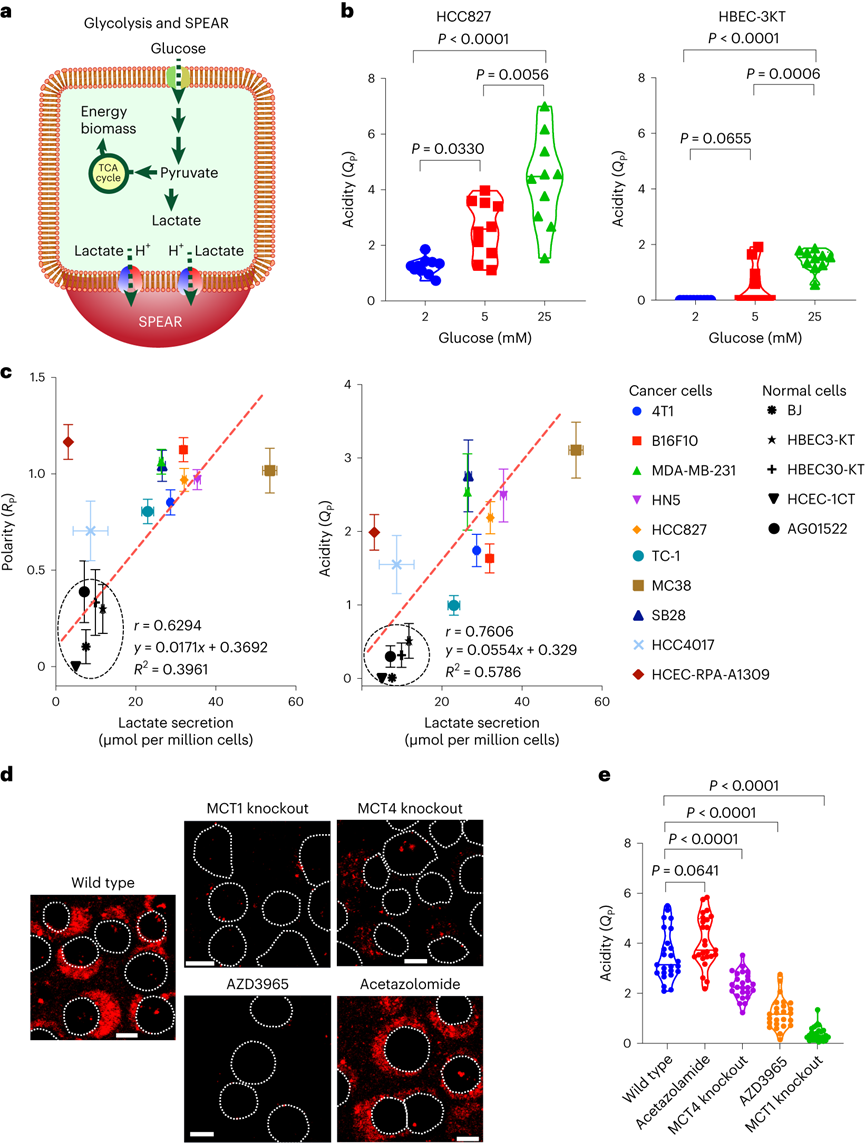
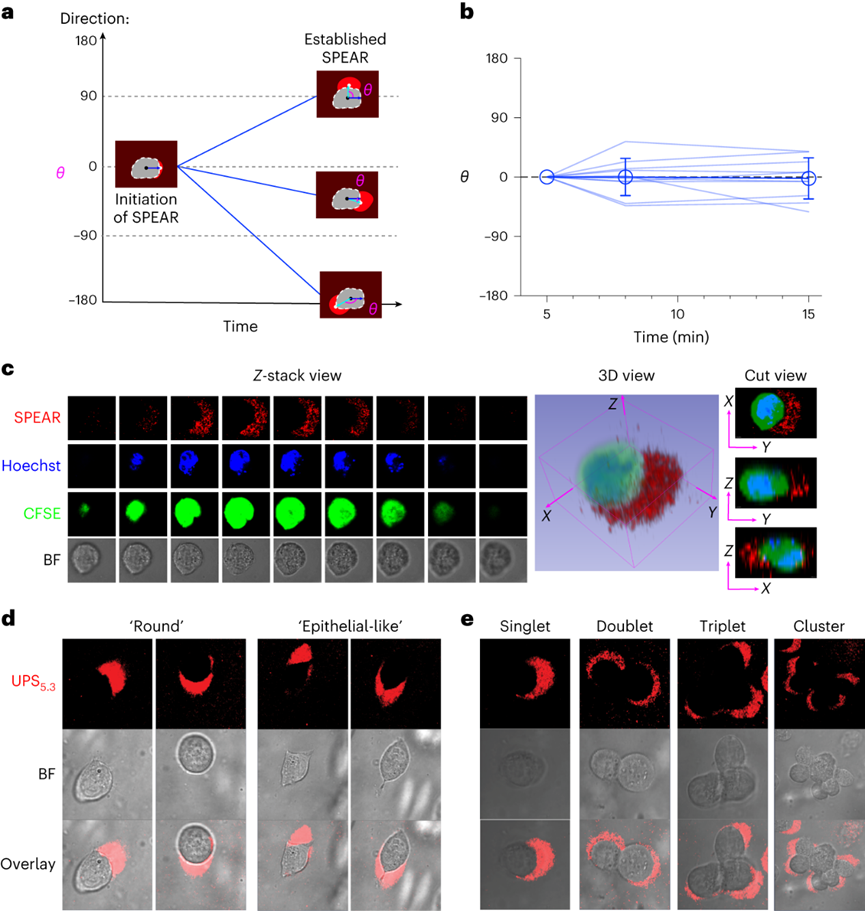
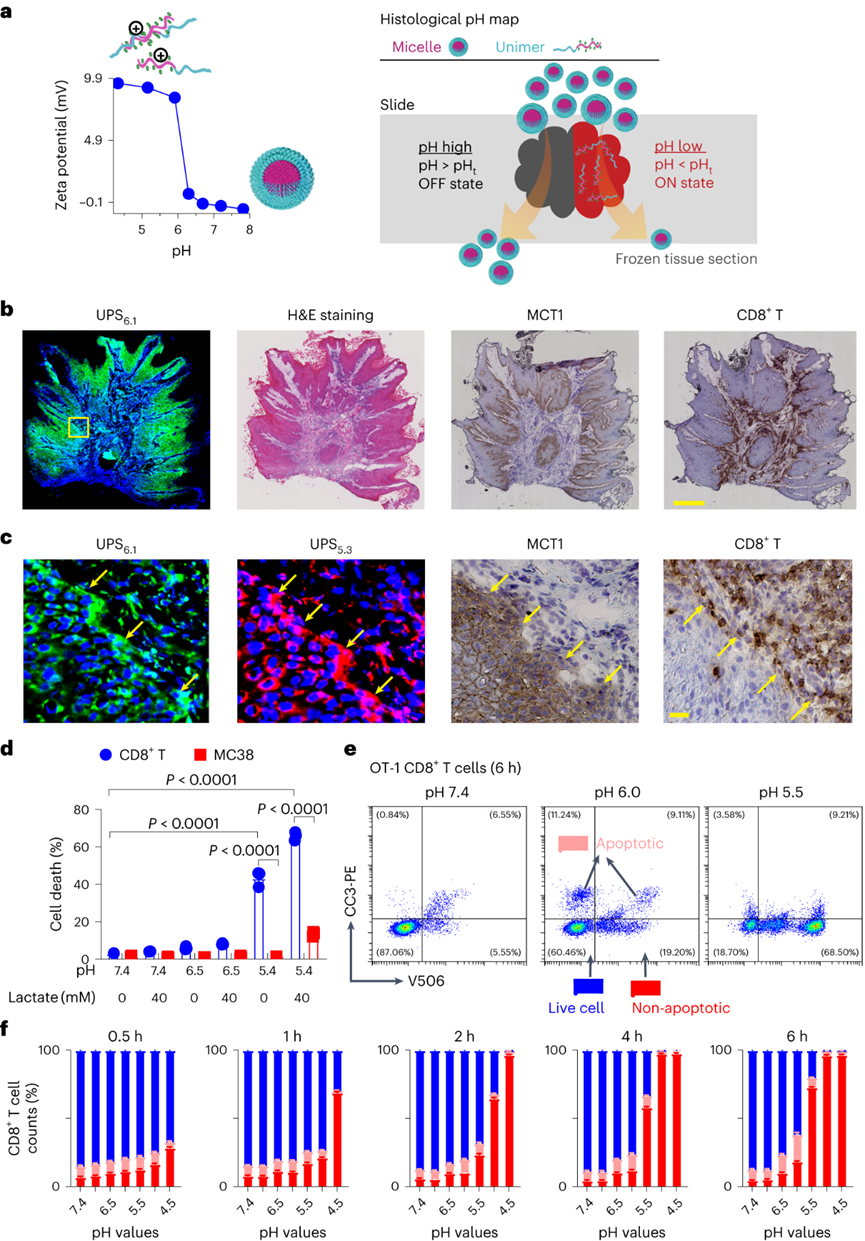
pH值是影響酶活性��、細(xì)胞代謝和組織穩(wěn)態(tài)的基本生理參數(shù)��,全身酸堿平衡是呼吸系統(tǒng)和腎臟系統(tǒng)最嚴(yán)格生理調(diào)控過程之一�����。在實體瘤中,癌細(xì)胞的高代謝活性和不良的血管灌注是腫瘤微環(huán)境中氫離子積累的原因。腫瘤酸度激活金屬蛋白酶以增加癌癥轉(zhuǎn)移風(fēng)險����,并抑制免疫細(xì)胞誘導(dǎo)腫瘤免疫逃避�。目前對腫瘤酸性細(xì)胞外pH值(pHe)的檢測多使用電極檢測或小分子pH傳感器(例如���,3-氨丙基膦酸酯)進(jìn)行磁共振波譜成像�����。但電極/磁共振波譜成像方法的局限是缺乏空間分辨率(~10 mm3)���,這可能低估了細(xì)胞或亞細(xì)胞酸化區(qū)的細(xì)胞外酸度���。近日�����,美國德克薩斯大學(xué)西南醫(yī)學(xué)中心高金明教授課題組利用其前期開發(fā)的超 pH 敏感 (UPS) 納米探針庫,研究了pH 5.3以下腫瘤酸度的細(xì)胞起源。UPS具有可調(diào)的 pH 通道和熒光激活���,以亞細(xì)胞空間分辨率的二進(jìn)制方式輸出 pH 信號。UPS 納米探針中的熒光團在正常生理 pH 值(7.4)下保持猝滅狀態(tài)。到達(dá)腫瘤后����,腫瘤酸度會激活低于其pH轉(zhuǎn)換閾值的納米探針��,從而在腫瘤中進(jìn)行熒光呈現(xiàn)。成像數(shù)據(jù)顯示,來自不同癌細(xì)胞組的極化細(xì)胞外酸度具有亞細(xì)胞分辨率。通過 MCT 分泌的乳酸似乎會導(dǎo)致嚴(yán)重的腫瘤酸中毒���,腫瘤微環(huán)境的酸性比以前報道的數(shù)值要強。作者團隊將嚴(yán)重極化的細(xì)胞外酸性區(qū)域 (SPEAR) 定義為癌細(xì)胞的未識別物理靶標(biāo),有望在廣泛的癌癥診斷和治療應(yīng)用中進(jìn)一步開發(fā)。當(dāng)環(huán)境pH值降至臨界閾值pH值以下時����,UPS聚合物會經(jīng)歷從膠束狀態(tài)到單聚體狀態(tài)的相變。在中性pH值下����,UPS聚合物保持膠束形式����,由于F?rster共振能量轉(zhuǎn)移(FRET)��,導(dǎo)致共軛染料的熒光信號猝滅(“OFF”狀態(tài))����。隨著環(huán)境質(zhì)子濃度的增加���,UPS膠束抵抗質(zhì)子化。直到環(huán)境pH值低于閾值時��,UPS聚合物完全質(zhì)子化����,熒光完全恢復(fù)。為了在體外研究單細(xì)胞水平的細(xì)胞外酸化,作者團隊在基質(zhì)膠中部署了一套具有特定 pH 轉(zhuǎn)換閾值的多色 UPS 納米探針(UPS6.9���、UPS6.1和UPS5.3)。由于每個納米探針在特定的pH激活下提供二進(jìn)制開/關(guān)pH讀數(shù),因此不同熒光基團的空間活化圖直接報告了每個癌細(xì)胞周圍亞細(xì)胞區(qū)域的酸性pH閾值�。在3.5 mM葡萄糖濃度下���,共聚焦成像顯示����,在孵育時間的30分鐘內(nèi)����,一組不同癌細(xì)胞系的細(xì)胞外酸化現(xiàn)象顯著�。在代表性的HCC827人肺癌細(xì)胞中觀察到SPEAR的形成,其中所有三個pH閾值傳感器的激活都發(fā)生在同一區(qū)域中����,而其他方向則無熒光��。SPEAR 區(qū)域的pH<5.3,比生理pH值高兩個數(shù)量級以上��。對其他 HN5���、MDA-MB-231和 4T1 的檢查顯示出相似的 SPEAR 現(xiàn)象�,表明極化酸化是不同癌細(xì)胞類型和物種的普遍現(xiàn)象。永生化支氣管上皮細(xì)胞(HBEC3-KT)作為正常細(xì)胞的非癌癥對照沒有檢測到SPEAR的形成�����。因此��,HCC827細(xì)胞表現(xiàn)出比HBEC3-KT細(xì)胞更高的細(xì)胞外酸化率(ECAR)��,UPS納米探針也基于圖像描繪了癌細(xì)胞質(zhì)子輸出的空間極性。在目前的成像條件下���,共聚焦顯微鏡進(jìn)行重復(fù)激光掃描時出現(xiàn)光漂白效應(yīng)。UPS5.3-TMR的熒光信號在每次連續(xù)掃描時都逐漸降低��,無論是在 OFF 還是 ON 狀態(tài)下�。因此必須建立一種定量方法來準(zhǔn)確測量 SPEAR 的形成。作者團隊引入質(zhì)子極性比(RP)和質(zhì)子數(shù)量(QP)分別測量細(xì)胞外酸化的極性和程度�����。RP定義為重心和酸度中心之間的距離與細(xì)胞平均半徑的比值��,QP作為歸一化的激活納米探針信號(SPEAR區(qū)域中的平均熒光強度(MFI)與非SPEAR區(qū)域之比)乘以 SPEAR 的面積(AF)���。QP和RP的量化在60次掃描中沒有顯示出顯著差異��,強調(diào)了UPS5.3-TMR對SPEAR量化的穩(wěn)定性���。研究4T1 癌細(xì)胞細(xì)胞外酸化的動力學(xué)過程���,盡管QP和RP在每個時間點的變異性很高�,但值會隨著時間的推移而增加。 QP–RP圖顯示了酸化隨時間變化的整體對角線軌跡,表明極化酸化主導(dǎo)了質(zhì)子輸出的動力學(xué)��。為了評估癌細(xì)胞與正常細(xì)胞中SPEAR現(xiàn)象的普遍性�,構(gòu)建了一個由十種癌細(xì)胞系和五種正常細(xì)胞系組成的多樣化細(xì)胞系組。盡管SPEAR具有變異性,但每個檢查的癌癥細(xì)胞系都激活了UPS5.3探針�,并在QP–RP圖和分級聚類樹狀圖中顯示出與正常細(xì)胞相比的不同聚類����,這表明SPEAR是癌細(xì)胞相對正常細(xì)胞而言的獨特特征��。癌細(xì)胞糖酵解增強是實體瘤的一個顯著特性�����,下游代謝物中如乳酸(pKa3.8)和碳酸(pKa6.1)是有機酸的主要貢獻(xiàn)者。在HCC827癌細(xì)胞中,低糖狀態(tài)下UPS5.3活化提示酸分泌水平低���,而高糖狀態(tài)下QP值(大于 4 倍)和異質(zhì)性顯著增加����。在HBEC3-KT細(xì)胞中觀察到類似的趨勢���,盡管整體酸化水平低于HCC827癌細(xì)胞誘導(dǎo)的水平��。在不同的細(xì)胞系中�����,RP和QP與乳酸分泌呈正相關(guān)�,Pearson相關(guān)系數(shù)分別為0.63和0.76。但是也觀察到幾個異常值(如,HCEC-RPA-A1309和MC38),這表明可能存在額外的酸化機制促進(jìn)SPEAR的形成。然而����,癌癥細(xì)胞的極化細(xì)胞外酸化特性與正常細(xì)胞明顯不同�����,這在很大程度上是癌癥細(xì)胞糖酵解活性升高的結(jié)果。為了進(jìn)一步建立乳酸排泄和SPEAR形成之間的因果關(guān)系��,用MCT轉(zhuǎn)運蛋白的基因敲除的HCC827細(xì)胞進(jìn)行實驗���。MCT1敲除與AZD3965化合物對MCT1的抑制均消除了納米探針的激活���。MCT4敲除降低了納米探針的激活�����,盡管與MCT1敲除相比程度較低�����。而乙酰唑胺抑制野生型HCC827細(xì)胞中碳酸酐酶IX對納米探針激活的影響不顯著。由于MCTs是質(zhì)子和乳酸陰離子的轉(zhuǎn)運體,探索細(xì)胞外乳酸濃度對納米探針激活的影響�����。40?mM L-乳酸鈉濃度逆轉(zhuǎn)了HCC827細(xì)胞中的乳酸轉(zhuǎn)運�,這消除了納米探針的激活。相比之下,40?mM D-乳酸則沒有消除效果��,這表明L-乳酸的阻斷作用來自于中斷的乳酸轉(zhuǎn)運�,而不是緩沖作用。圖 糖酵解介導(dǎo)的乳酸輸出驅(qū)動SPEAR的形成探索癌細(xì)胞SPEAR方向是否一致,或者這種方向是否會隨著時間的推移而改變�����。分析SPEAR的起始與其隨后的維持位置之間的角度(θ)���。平均角度(θ)接近于零表明癌細(xì)胞在圖像采集時間(30 分鐘)內(nèi)保持相同的酸分泌軌跡����。具有圓形或紡錘形形態(tài)的癌細(xì)胞無論形狀如何�����,都顯示出極化的酸化模式��。在分離的單個癌細(xì)胞作為單元存在的基質(zhì)膠中,SPEAR的方向是隨機的�����。然而���,當(dāng)在較高的細(xì)胞接種密度下細(xì)胞間接觸發(fā)生時�,它會顯著影響 SPEAR 的方向。在這種情況下��,SPEAR主要將朝向遠(yuǎn)離細(xì)胞-細(xì)胞界面和細(xì)胞簇的外圍���。這一結(jié)果強調(diào)了細(xì)胞通過同一區(qū)域分泌酸進(jìn)入細(xì)胞外空間�,避免與鄰近的癌細(xì)胞接觸�。細(xì)胞間接觸對SPEAR趨向性的調(diào)節(jié)尚不清楚�,需要進(jìn)一步研究。嚴(yán)重腫瘤酸化導(dǎo)致的T細(xì)胞排外和死亡:為了研究腫瘤酸度����,噴灑UPS納米探針(UPS6.1或UPS5.3)到新鮮冷凍和切片的腫瘤載玻片上,并使用熒光共聚焦顯微鏡對納米探針激活進(jìn)行成像��。在這項研究中��,在手術(shù)過程中切除頭頸癌患者的腫瘤和鄰近的正常組織��,并立即包埋并冷凍在最佳切割溫度介質(zhì)中,漂浮在液氮(<10 s)中以避免厭氧糖酵解�。H&E染色顯示了基于組織形態(tài)學(xué)和細(xì)胞核形態(tài)學(xué)的腫瘤和基質(zhì)劃分�����。UPS活化圖顯示了腫瘤微環(huán)境中細(xì)胞外酸度的異質(zhì)模式。在具有代表性的分化良好的鱗狀細(xì)胞癌病例中���,粘膜下基質(zhì)的酸性低于浸潤性腫瘤細(xì)胞。腫瘤-基質(zhì)界面的較高放大倍率突出了基質(zhì)組織周圍柵欄癌細(xì)胞的極化腫瘤酸度�����。并非所有腫瘤區(qū)域內(nèi)的癌細(xì)胞都表現(xiàn)出SPEAR�,而基質(zhì)區(qū)域中的一些非癌細(xì)胞表現(xiàn)出SPEAR,這可能歸因于細(xì)胞-細(xì)胞接觸介導(dǎo)的抑制���,或腫瘤微環(huán)境中的異質(zhì)營養(yǎng)/氧轉(zhuǎn)運。MCT1的IHC檢測顯示�����,在基質(zhì)-腫瘤界面附近的腫瘤細(xì)胞上表達(dá)更高�。然而,MCT1表達(dá)在基質(zhì)中大多不存在����,CD8+毒性T細(xì)胞在基質(zhì)區(qū)室內(nèi)隔離�����,腫瘤組織中的CD8+ T細(xì)胞浸潤最小。詳細(xì)說明嚴(yán)重腫瘤酸度(pHe<5.3) 和 T 細(xì)胞排外�,研究培養(yǎng)基 pH 值對T 細(xì)胞活力的影響。在pH 6.5或更高時�����,T細(xì)胞存活(<5%死亡)�,與高乳酸濃度無關(guān)。相反����,在 pH 值為 5.4 時死亡(>40%)顯著����。在pH 5.4下添加40 mM乳酸進(jìn)一步將死亡百分比提高到60%以上����。相比之下,MC38結(jié)直腸癌細(xì)胞即使在pH 5.4下仍保持活力。據(jù)報道,酸性pH值可誘導(dǎo)CD8+ T細(xì)胞凋亡��。在 pH 6.0 和 6.5 下����,大約 20% 的 CD8+T 細(xì)胞在孵育 6 小時后發(fā)生凋亡,而在 pH 5.5 及以下時,非凋亡性的細(xì)胞死亡 (>60%) 在 4 小時后占主導(dǎo)地位。數(shù)據(jù)表明,當(dāng)達(dá)到 pH 閾值(例如,低于5.5)時���,CD8 T+ 細(xì)胞死亡會從凋亡途徑轉(zhuǎn)變?yōu)榉堑蛲鐾緩健?/span>圖 人類頭頸部腫瘤樣本中的影像學(xué)腫瘤酸中毒和T細(xì)胞排外作者團隊的研究表明,即使在單細(xì)胞水平上也存在嚴(yán)重的腫瘤酸化,這表現(xiàn)為一組癌細(xì)胞的嚴(yán)重極化細(xì)胞外酸性區(qū)域(SPEAR)��。SPEAR沿著特定的軌跡�,質(zhì)子輸出優(yōu)先發(fā)生在一個方向上,這提供了一個高度濃縮的酸度區(qū)(pH值e<5.3)比以前估計的要高出一個數(shù)量級。盡管對SPEAR進(jìn)行定量發(fā)現(xiàn)在癌細(xì)胞中始終觀察到高度濃縮的細(xì)胞周酸中毒區(qū)域���,而不是正常細(xì)胞則沒有。SPEAR的形成與較高的糖酵解率和乳酸分泌率相關(guān),而 MCT 的基因敲除或抑制可消除 UPS5.3激活����。極化酸化現(xiàn)象為設(shè)計腫瘤靶向療法提供了新的機會����,同時促進(jìn)了細(xì)胞生理學(xué)的理解����。由于質(zhì)子輸出量較少,極化導(dǎo)致質(zhì)子濃度增加,但與均勻的酸分泌相比,也限制了治療靶向的區(qū)域��,這使工程設(shè)計能夠?qū)W⒂诘?pH 閾值靶向�����。同時�,需要考慮SPEAR形成的空間和時間異質(zhì)性�。驅(qū)動這種極化現(xiàn)象的機制目前尚不清楚。細(xì)胞通過涉及細(xì)胞骨架重排、細(xì)胞外和細(xì)胞內(nèi)信號傳導(dǎo)以及細(xì)胞器分布的復(fù)雜相互作用表現(xiàn)出極性���。幾種假設(shè),包括乳酸轉(zhuǎn)運蛋白的極化激活,乳酸生成中心的不均勻分布和細(xì)胞間接觸控制。目前的數(shù)據(jù)顯示�����,SPEAR異質(zhì)性是一種細(xì)胞固有特性�����,在體外和體內(nèi)都很明顯���。SPEAR在單個細(xì)胞中的體外觀察不僅揭示了癌細(xì)胞和非癌細(xì)胞之間的區(qū)別���,而且還突出了每種癌細(xì)胞系內(nèi)的內(nèi)部差異��。除了固有的變異性外���,營養(yǎng)和氧氣、細(xì)胞間接觸�、通過血液灌注或淋巴引流產(chǎn)生的質(zhì)子沖洗�、通過局部乳酸穿梭消耗乳酸和其他未知變量等因素也可能導(dǎo)致患者腫瘤組織中 SPEAR 的形成。輕度腫瘤酸度(pHe6.5–6.8)是一種公認(rèn)的免疫抑制因子��,可阻礙細(xì)胞毒性淋巴細(xì)胞���、細(xì)胞因子信號傳導(dǎo)和針對癌細(xì)胞的抗體反應(yīng)���。細(xì)胞活化 V 結(jié)構(gòu)域免疫球蛋白抑制因子 (VISTA) 在酸性 pH 值下選擇性地結(jié)合和抑制 T 細(xì)胞��。酸性 pH 值 (6.5) 阻礙白細(xì)胞介素2 信號傳導(dǎo)和 CD8+ T 細(xì)胞活化�。該研究發(fā)現(xiàn)的 SPEAR 表型表明腫瘤中存在嚴(yán)重的酸化��,這可能會進(jìn)一步加劇免疫細(xì)胞死亡���。患者腫瘤組織的離體染色顯示��,在基質(zhì)-腫瘤組織界面處形成低于 pH 5.3 的酸壁,阻斷了 CD8+ T 細(xì)胞浸入�。乳酸的極化分泌會產(chǎn)生排他區(qū)�,在細(xì)胞間接觸時消滅CD8+ T細(xì)胞�����,這為癌細(xì)胞提供了生存優(yōu)勢�����。Qiang Feng, Zachary Bennett, Anthony Grichuk, et al. Severely polarized extracellular acidity around tumour cells. Nat Biomed Eng. 2024 Mar 4.https://www.nature.com/articles/s41551-024-01178-7