
1.設計配體用于立體選擇性/位點選擇性C-H鍵糖苷化;4.拓展了糖苷分子庫,得到的季碳立體結構糖苷是以往方法無法生成。碳水化合物在藥物化學以及生物化學領域非常重要,但是碳水化合物的合成通常需要設計結構特定的糖苷供體,這導致需要許多步驟。此外,如何向糖的環狀結構安裝含有立體結構的芳基化季碳原子仍然是個巨大的挑戰。有鑒于此,武漢大學孔望清教授、戚孝天教授等報道一種簡單多功能的方法合成結構多種多樣的C-R(R=芳基、雜芳基、烯基、炔基、烷基)糖苷。該反應的條件溫和,對廣泛的糖苷結構表現優異的立體選擇性。反應能夠合成具有挑戰性的2-脫氧糖苷,沒有保護基的糖苷,非經典糖苷,氘代糖苷。此外,作者發展了能夠控制在特定位點進行發散性合成的方法,能夠合成其他方法無法得到的含芳基季碳立體結構。通過合成藥物活性分子和碳水化合物表現了該反應方法的合成應用。1-脫氧糖苷能夠通過市售1-乙酰基碳水化合物分子的Nair過程生成,而且1-脫氧糖苷分子具有穩定性,能夠大規模的合成和提純處理。這種合成方法能夠用于合成種類廣泛的糖苷,包括呋喃糖和吡喃糖。反應兼容性。優化了反應條件后,研究該反應的兼容性和普適性。反應兼容缺電子或者富電子的芳基溴化物,反應對許多官能團表現了優異的容忍性,包括酮、腈、酯、砜、酰胺等官能團(3-7),收率達到53-72 %。此外,對呋喃、吡啶、嘧啶等官能團兼容,能夠得到較高產率(8-10)。反應的局限性。呋喃核糖(11-12)、阿拉伯呋喃糖(13)、氟化糖(14)以及葡萄糖和甘露糖(15-17)衍生物都能夠安裝芳基,并且具有優異的立體選擇性。反應對多種多樣的吡喃糖進行芳基化,包括木糖、鼠李糖和葡萄糖(18-21),并且得到優異的立體選擇性。2-脫氧核糖(22)能夠生成α-和β-位點反應的混合物,這是因為缺乏α-/β-空間分辨。需要注意的是,該反應能夠生成C3位點修飾氨基的C-芳基糖苷(23),這種結構的糖苷有可能作為與DNA結合的試劑。2-脫氧葡萄糖、2-脫氧半乳糖和2-脫氧麥芽糖能夠以60-77 %的產率和優異的α-選擇性生成C-芳基化糖苷(24-26)。需要注意的是,這種方法能夠以非常高的選擇性生成芳基化的C-呋喃苷(27-29)和芳基化的C-吡喃苷(30-31)。與現有方法不同,發展的這種合成方法能夠位點選擇性的對吡喃核糖實現位點選擇性的芳基化(32),生成非經典的C-糖苷(33),同時分子中的端基碳能夠進一步的通過現有合成方法轉化為其他官能團。
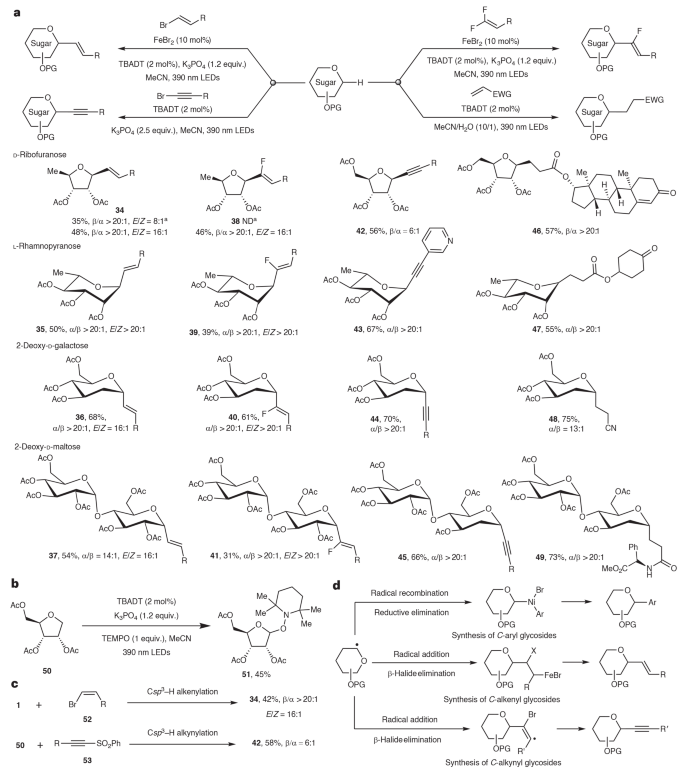
進一步發展。這種方法能夠拓展TBADT/Fe雙功能催化劑體系與E-鹵烯烴進行交叉偶聯生成C-烯基糖苷(34-37),反應得到優異的立體選擇性和E式選擇性。反應能夠生成以偕-二氟烯烴作為反應物,以>16:1的E式選擇性生成C-氟烯基糖苷(38-41)。此外,當使用炔烴溴作為反應物,發展了無金屬催化反應體系,以較高的活性和立體選擇性生成C-炔基糖苷化合物(42-45)。而且,通過Giese加成反應能夠較高的產率和選擇性生成含有多種極性官能團的C-烷基糖苷(46-49)。該反應的兼容性和可靠性展示比現有方法的底物兼容更有優勢。初步的機理研究。使用TEMPO自由基捕獲劑,發現該反應包括糖苷自由基中間體。通過控制實驗,發現反應不論加入的糖苷立體選擇性如何,都能夠生成單一的E式產物。結果說明反應的Csp3-H烯基化/炔基化的過程包括自由基加成/β-鹵消除反應。當使用FeBr2替代NiBr2,無法生成3產物,說明Ni能夠捕獲糖苷自由基,隨后發生還原消除反應生成產物。TBADT具有高能量的激發態,能夠切斷C(sp3)-H鍵(化學鍵解離能量BDE達到100 kcal mol-1)。十鎢酸鹽陰離子體積非常大,因此在HAT反應中產生立體效應。通過這兩個作用,以及立體選擇性,使得Ni催化產生位點選擇性的C(sp3)-H官能團化。作者研究了該反應對糖分子的位點發散轉化。對于縮丙酮基(acetonide)保護的糖苷分子,TBADT能夠參與多個α-C-H化學鍵的HAT反應過程,因為這些C-H化學鍵具有類似的BDE鍵解離能量,因此對C1位點和C2位點進行芳基化都有可能性。Ni催化具有獨特的性質,因此人們發展了許多配體調控的位點發展轉化反應。因此,通過配體結構設計,能夠在Ni催化糖苷的交叉偶聯反應中實現C1或C2位點的切斷,這種方法實現了位點選擇性的C(sp3)-H官能團化,不必位點選擇性切斷C-H化學鍵。對各種結構不同的配體進行測試,發現立體位阻的三齒配體tbtpy(L2, 4,4′,4′′-tri-tert-butyl-2,2′:6′,2′′-terpyridine)能夠對56號分子在C1位點糖苷化,產率為75 %;當使用雙齒配體dtbbpy(L1, 4,4′-di-tert-butyl-2,2′-dipyridyl)能夠以67 %的產率生成含有季碳立體位點的60。測試發現,反應沒有生成C3-芳基化產物。含有密集季碳立體結構位點的碳水化合物兼容性。比如多種保護基團(62-65)以及羥基(66-67)的底物表現了較好的產率和優異的位點選擇性/立體選擇性。蔗糖(68-69)以及甘露糖(71-72)等六吡喃糖能夠分散性的對C3和C6位點芳基化,同時保留端基碳原子用于隨后的官能團化轉化。阿拉伯糖(74-75)、甘露糖(76-77)和鼠李糖(78-79)等吡喃糖同樣在產物生成高選擇性。這些實驗結果說明反應的選擇性完全受到配體結構的控制。反應能夠對許多偶聯試劑用于C3位點官能團化轉化,以位點選擇性和立體選擇性含有季碳立體結構的產物(86-89),而且反應的端基碳能夠進一步官能團轉化。從合成的角度來看,這個反應方法能夠從結構簡單的原料生成現有方法難以實現的結構復雜產物,說明這種方法學的優勢。通過氘代標記實驗研究位點發散官能團化反應的配體效應。制備了α-1-氘代糖苷化合物(α-1-D),發現能夠以72 %的收率生成C-糖苷化的3-D,氘代比例達到94 %。β-1-D生成55 %的3產物,而且反應產物沒有氘代原子取代的信號。這些結果說明HAT過程具有立體選擇性,TBADT選擇性的在低立體位阻β-面發生反應。動力學同位素效應。使用2-氘代反應物90-D進行C-2芳基化,沒有發現氘代效應。研究90和91之間的競爭研究動力學同位素效應(KIE, kH/kD),結果顯示KIE達到1.3,說明反應更容易在C2位點而不是C1位點發生,HAT反應不是決速步。在不加入TBADT的情況,1和D2O進行H-D交換實驗,發現只有在C1位點發生D代。研究90和D2O之間的H-D交換,發現在C1和C2位點都產生D代。這些結果說明HAT可逆過程,與預測相符。基于實驗機理研究進行DFT理論計算,研究反應路徑和配體控制位點選擇性的機理。計算結果顯示3Ni(0)L1和3Ni(0)L2催化體系生成56和57的反應,首先自由基捕獲及逆行單電子氧化Ni(0),隨后與芳基溴之間兩電子氧化加成/C-C還原消除,生成芳基化的59和60。計算結果顯示L1和L2過程的反應機理是相同的,但是位點選擇性不同。在3Ni(0)L1芳基化反應中,捕獲2°(56)和3°(57)自由基的活化能相似,對3°自由基57具有強驅動力,而且隨后的2電子氧化加成更低的活化能,因此3Ni(0)L1具有C2位點選擇性。在含有三齒配體(L2)的3Ni(0)L2催化芳基化反應中,單電子氧化步驟的3°自由基和2°自由基反應趨勢相反,Ni(0)與57的單電子氧化能壘比與56的能壘高1.1 kcal mol-1,這種能量上的區別來自位阻效應,使用大位阻L2配體導致放大57和56的位阻區別,因此高位阻效應的3Ni(0)L2催化體系通過動力學控制單電子氧化步驟,實現了C1位點選擇性芳基化。Xu, S., Ping, Y., Xu, M.et al. Stereoselective and site-divergent synthesis of C-glycosides. Nat. Chem. (2024).DOI: 10.1038/s41557-024-01629-3https://www.nature.com/articles/s41557-024-01629-3
