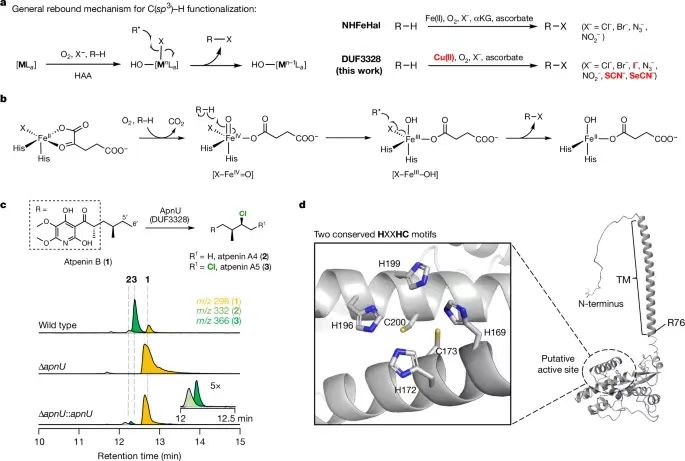
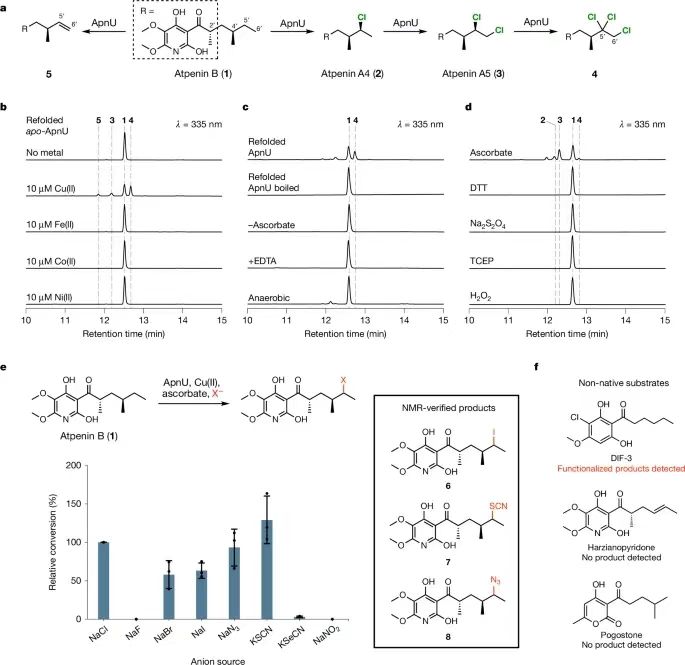
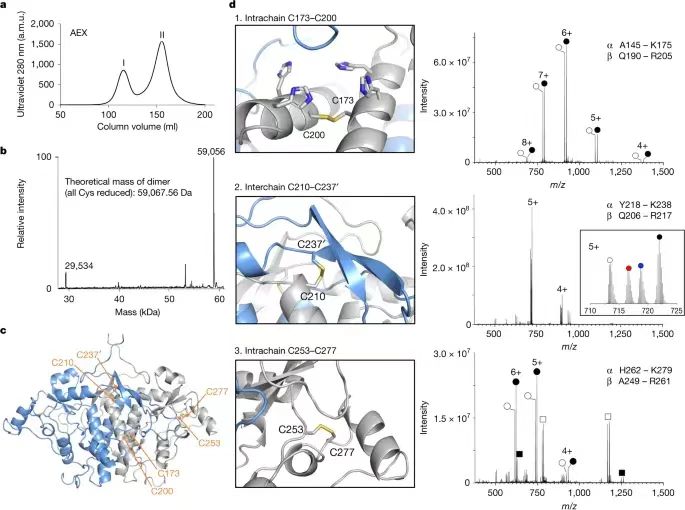
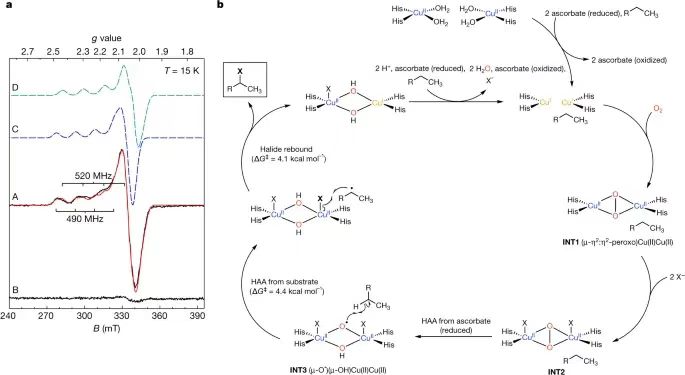
唐奕教授本科畢業于賓夕法尼亞州立大學,在David A. Tirrell教授完成博士,在Chaitan Khosla教授的指導下完成了博士后的工作,他的研究方向主要集中在天然產物生物合成和生物催化領域。曾獲美國總統獎、美國化學學會Author C. Cope 獎等多項殊榮。C-H鍵是有機分子中最常見的化學鍵,因此C-H鍵在化學合成中處于非常重要的地位。C-H鍵轉化反應關鍵的挑戰是如何選擇性對特定C(sp3)-H化學鍵進行轉化。在這些年,人們發現金屬酶能夠催化C(sp3)-H化學鍵的官能團化。雖然近些年得到顯著的發展和進步,但是對惰性C(sp3)-H鍵的酶催化鹵化反應仍然只能通過非血紅素Fe/α-酮戊二酸依賴性鹵化酶(α-ketoglutarate-dependent halogenase),因此導致化學可及性受到局限。 有鑒于此,加州大學洛杉磯分校唐奕教授、Masao Ohashi教授等報道在含有未知功能結構域3328(DUF3328)的蛋白質家族中,發現了一種未曾發現的鹵化酶ApnU,并進行表征。ApnU在活性中心位點使用Cu作為催化劑,對多個惰性C(sp3)-H鍵進行迭代催化氯化。通過Cu金屬中心具有的較軟特點,ApnU展現了出乎預料的酶催化C(sp3)-H官能團化性能,包括碘化(iodination)和硫氰化(thiocyanation)。通過生化特征和蛋白質組學分析,鑒定了ApnU的低聚功能態(oligomeric state),這種低聚態呈現了共價連接的二聚體,其中含有由雙硫鍵形成的三個基本結構,一對是鏈間雙硫鍵,兩對鏈內雙硫鍵。通過ESR表征,驗證ApnU含有的金屬配位活性位點含有雙核II型Cu中心位點。這項研究發現拓展了鹵酶催化C(sp3)-H鹵化反應的能力,為雙核Cu依賴性氧化酶的提供基礎性的理解。酶的功能未知3328(DUF3328)域在真菌天然產物生物合成途徑中廣泛的存在,根據其基因特點,其包括C(sp3)-H氧化官能團化,包括成環、去飽和、羥基化、氯化。ApnU是這種酶家族的一種,比如atpenin B (1), atpenin A4 (2), atpenin A5 (3)(圖1c)。首先,通過基因失活( genetic inactivation)驗證了ApnU在氯化反應中由1轉化為2和3的情況,發現敲除apnU之后,2和3消除,但是1逐漸累積;隨后,補充apnU之后,恢復了生成2和3的活性。 通過分析序列和結構,發現ApnU含有兩個HXXHC結構,四個His側鏈能夠形成平面的四個角(約5.4?×6.1?),兩個半胱氨酸殘基位于平面下方(圖1d)。ApnU的結構預測結果表明其含有49個殘基(編號31-79)的N-終端跨膜螺旋結構(N-terminal transmembrane helix)(圖1d)。將75 N終端殘基替換為可溶的標簽(10個氨基酸序列:MAKKTSSKGK),得到部分可溶的蛋白并進行提純。將純化的蛋白與1、康壞血酸、NaCl一起進行培養,發現1轉化為單氯化2主要產物的轉化率較低(10 %),生成二氯化產物3次要產物。向反應中加入EDTA后反應活性消失,表明酶催化活性具有金屬依賴性。在優化的條件下,能夠從包涵體中重新折疊蛋白質,獲得可溶的ApuU。將重新折疊的apo-ApnU與1、抗壞血酸、各種過渡金屬(Mn(II), Fe(II), Co(II), Ni(II), Cu(II), Zn(II))進行培養,LC-MS表征結果表明,只有在Cu(II)存在時,1具有氯化反應活性,50 %的1轉化為氯化產物3和4。其中,4的質譜為m/z=400,對應于三氯化產物。此外發現少量5產物(m/z=296),對應于1的脫氫產物。放大量反應并且分離4和5,進行NMR表征。NMR表征結果表明4號分子的第三個氯位于3的C5′位點,得到偕二氯的四級碳原子。總之,以上研究結果表明ApnU是首個被發現能夠迭代C(sp3)-H氯化的Cu依賴性鹵化酶。 與大多數Cu金屬酶相似,ApnU通過O2作為氧化劑活化C-H鍵,在無氧條件下ApnU沒有表現催化活性(圖2c)。抗壞血酸作為必不可少的還原劑,其他的還原劑(比如DTT(二硫蘇糖醇)和Na2S2O4)無法用于氯化反應(圖2d)。在pH 6.0 MES緩沖液中,ApnU獲得最好的氯化反應活性。當NaCl濃度增加,氯化程度(3 vs 4)增加,在濃度為50 mM NaCl時得到最大的氯化反應數目。在沒有氯化物的情況,整體催化活性明顯降低,表明氯化物與Cu中心之間的配位對于C(sp3)-H鍵活化非常重要。由于ApnU使用的是軟金屬Cu用于鹵化反應,因此作者認為ApnU能夠與Fe依賴性NHFeHal起到不同的鹵化物/準鹵化物進行反應。因此,將不含氯的ApnU與1以及不同的陰離子進行活性測試,結果表明能夠與Br-、N3-、NO2-生成官能團化的加合物(與Fe依賴性NHFeHal類似)。此外,柔性更高的陰離子(I-、SCN-、SeCN-)同樣能夠反應(Fe依賴性NHFeHAl不具有這種催化活性)。在這些陰離子濃度更高的情況下,反應只能生成單取代的產物,而且沒有副產物生成。放大量實驗能夠合成并分離碘化物、硫氰酸鹽產物、硒氰酸鹽產物(6-8)。通過NMR分析發現反應的區域選擇性是C5′(圖2e)。當使用F-、CN-、OCN-、HCOO-、NO3-、CH3S-,未見產物生成(圖2e)。ApnU的獨特Cu活性位點使得ApnU實現了區域選擇性的C(sp3)-H官能團化轉化。這種非Fe依賴性鹵化酶拓展了酶催化C(sp3)-H鍵官能團化的種類。在重新折疊形成ApnU的過程中,需要加入GSH/GSSG,當GSH和GSSG的量相同,折疊的效果最好。當不加入GSH/GSSG,雖然能夠獲得可溶的蛋白,但是得到的蛋白完全沒有催化活性。這個結果表明ApnU的六個半胱氨酸進行正確重構是蛋白質折疊的關鍵。 使用陰離子交換色譜、尺寸排阻色譜表征,發現重新折疊的ApnU具有兩個主要物種(I和II),質量為30 kDa(圖3a)。分別分離并提純,發現只有I具有氯化酶的催化活性,II沒有氯化酶的催化活性。通過LC-QTOF-MS表征變性蛋白的質譜,發現分子量為59,056 Da,對應于ApnU的二聚體,并且對應于由于生成二硫化學鍵導致減少12-Da(圖3b)。通過天然蛋白質的質量分析,進一步證實了ApnU的二聚體狀態。對HXXHC的四個his進行突變,驗證四個his對于ApnU的活性都是必須的,這可能是因為其Cu結合的作用。通過ICP-MS表征His6-tag-free ApnU,發現每個ApnU的金屬最大結合數目為2.3±0.1。通過EPR表征His6-tag-free ApnU的Cu中心位點結構和性質。當加入過量的Cu(II),并且通過脫鹽或者透析處理干凈樣品,含有Cu(II)的ApnU的EPR譜結果表明type II型Cu(II)信號,每個活性位點具有接近2個Cu原子自旋(圖4a)。加入過量抗壞血酸或者在無氧條件測試,發現Cu(II) EPR信號消失,驗證了抗壞血酸將Cu(II)還原為Cu(I)啟動催化反應。 模擬EPR譜的結果表明兩個有所區別的Cu(II)信號g值和超精細耦合常數Az(Cu)(圖4a),表明每個Cu(II)處于N/O混合配位環境和平面四方形結構。觀測的g≈2.05的信號超精細裂分結果分析發現應該是14N與Cu(II)之間的超精細相互作用,這個結果支持了Cu結合位點。光譜表征結果表明,靜息態的兩個Cu沒有磁耦合,表明兩個Cu(II)原子的間距超過6 ?。根據實驗結果,以及已知的雙核Cu酶催化機理,DFT理論計算,提出了ApnU的可能鹵化反應機理(圖4b)。靜息態含有兩個沒有耦合的Cu(II)中心,隨后通過抗壞血酸還原為Cu(I),隨后O2活化生成過氧橋連雙核INT1(μ-η2:η2-peroxo)Cu(II)Cu(II)。Cu中心與陰離子配位,形成INT2,通過抗壞血酸發生摘氫原子反應生成INT3(μ‐O·)(μ‐OH)Cu(II)Cu(II)。INT3是反應活性物種,能夠從反應物1摘氫,計算結果表明該步驟的能壘為4.4 kcal mol-1,通過該步驟生成鹵化產物,同時消耗一個Cu(II)位點。隨后另一個Cu(II)與抗壞血酸反應重新開始催化反應。這項研究發現了從前未知的ApnU(從屬于真菌蛋白的DUF3328家族),并且進行生化分析表征。ApnU是Cu依賴性催化劑,能夠對多個C(sp3)-H鍵進行迭代的氯化,ApnU含有保守的雙HXXHC結構(其他DUF3328蛋白同樣存在),通過EPR和ICP-MS表征驗證與兩個Cu(II)金屬離子結合。ApnU的Cu中心具有超預料的C(sp3)-H官能團化性能,這些催化活性與Fe的鹵化酶不具備的。雖然人們發現黃素依賴性鹵化酶能夠進行區域選擇性C(sp3)-H碘化,但是ApnU能夠進行位點選擇性的C(sp3)-H碘化反應、硫氰酸化反應、硒氰酸化反應。Fe依賴性酶雖然具有優秀的催化活性,而且容易進行進化,但是Cu依賴性酶仍然展現了對酶催化C(sp3)-H鍵官能團化反應種類的拓展。這項工作為研究目前未曾關注的DUF3328金屬酶家族提供廣闊的機會,有助于開發新型酶功能。 Chiang, CY., Ohashi, M., Le, J. et al. Copper-dependent halogenase catalyses unactivated C?H bond functionalization. Nature (2025).DOI: 10.1038/s41586-024-08362-4https://www.nature.com/articles/s41586-024-08362-4