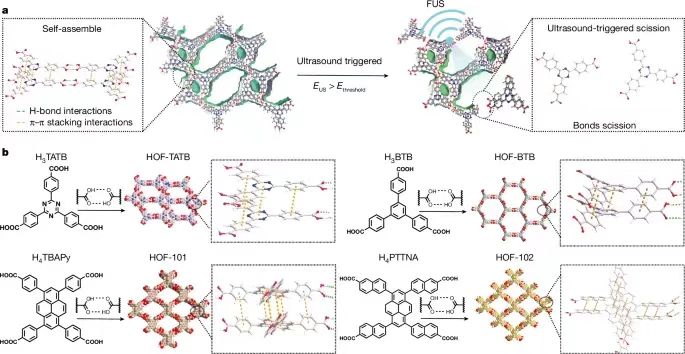
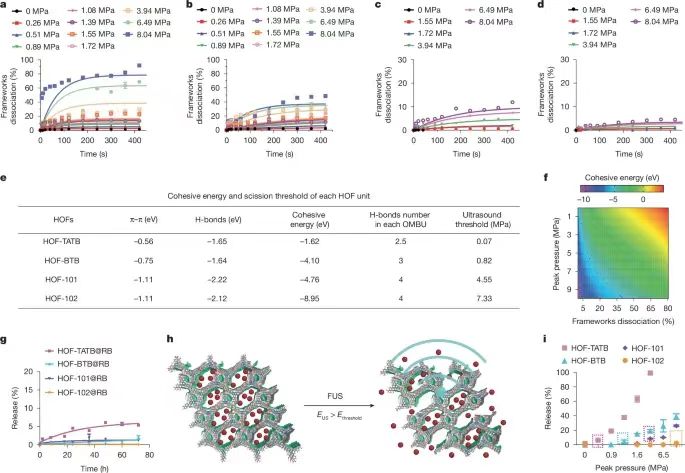
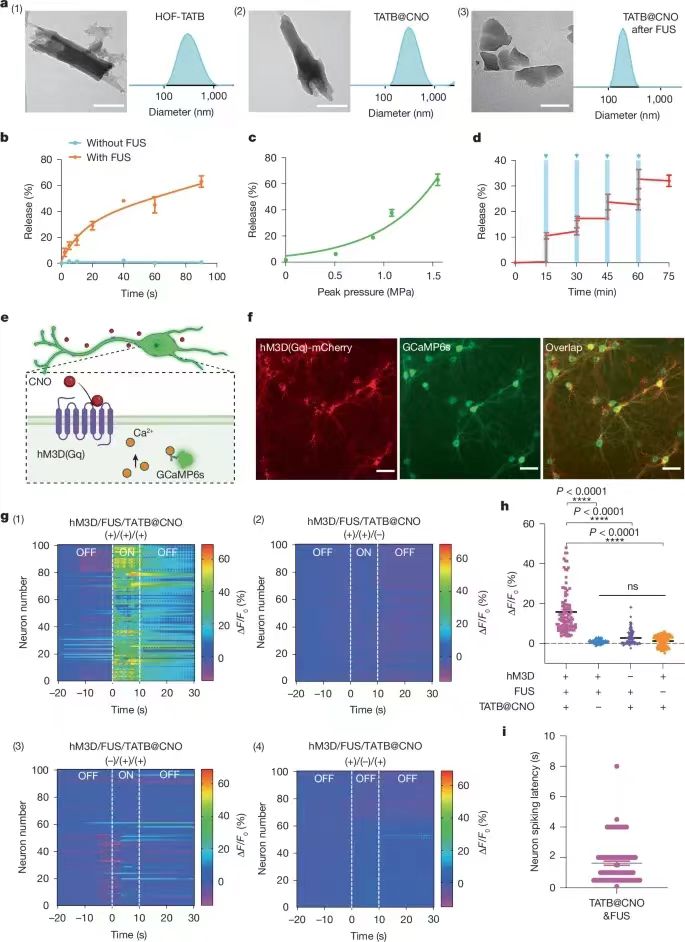
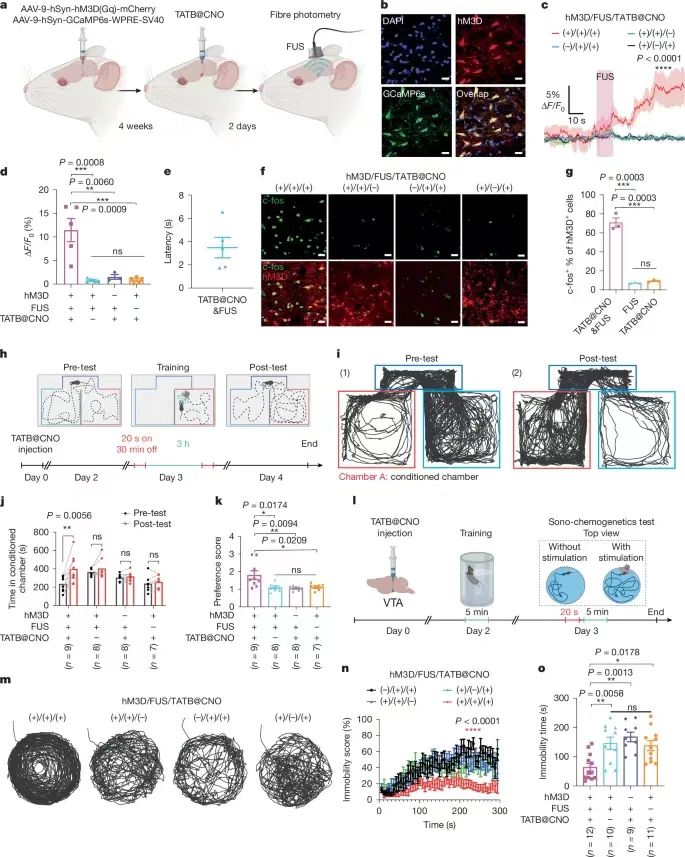
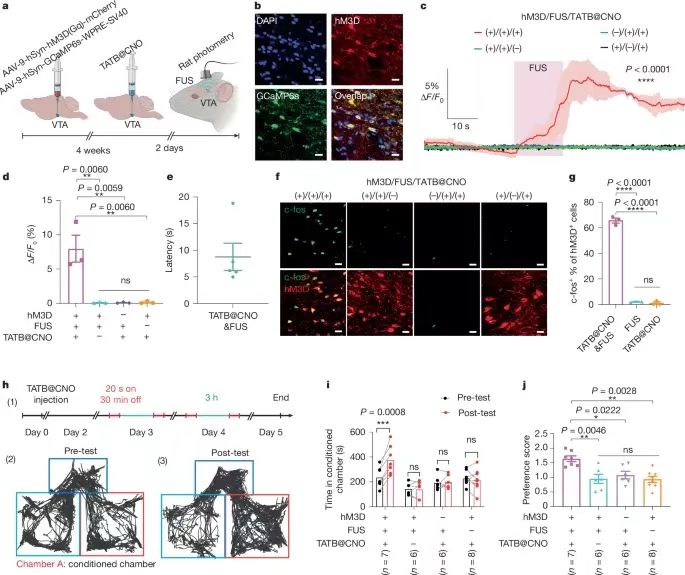
通過非侵入式的超聲方式進(jìn)行精切控制深層組織的機(jī)械化學(xué)活化��,對(duì)于深入理解基礎(chǔ)生物醫(yī)學(xué)以及改變疾病治療的方法意義深遠(yuǎn)�。但是目前還沒有開發(fā)一種具有超聲激活的理論指導(dǎo)的機(jī)械響應(yīng)材料體系���。有鑒于此�����,德州大學(xué)奧斯汀分校助理教授王輝亮�����、德州大學(xué)圣安東尼奧分校陳邦林教授等報(bào)道了通過聚焦超聲FUS(focused ultrasound)程序控制策略�,對(duì)氫鍵有機(jī)框架材料(HOF)控制激活藥物��,通過按照需要的方式切斷超分子相互作用����,實(shí)現(xiàn)控制深部大腦內(nèi)的特定細(xì)胞事件����。開發(fā)了一種理論模型,能夠?qū)C(jī)械切斷和超聲機(jī)械力學(xué)進(jìn)行可視化的成像觀測(cè)���,因此能夠提供具有價(jià)值的指導(dǎo)用于理性設(shè)計(jì)可編程控制的機(jī)械響應(yīng)材料。為了驗(yàn)證這種方法的有效性�,設(shè)計(jì)將藥物分子氯氮平CNO(clozapine N-oxide)組裝到HOF納米晶體內(nèi)�,通過FUS控制釋放藥物分子��,激活小鼠和大鼠VTA區(qū)域的工程化G蛋白偶聯(lián)受體����,能夠?qū)? mm深層的靶向神經(jīng)回路進(jìn)行調(diào)控����,僅僅延遲數(shù)秒�。 這項(xiàng)工作展示了超聲能夠精確的控制分子之間相互作用,用于開發(fā)超聲編程HOFs用于非侵入式和時(shí)間空間分辨的細(xì)胞事件控制���,因此有助于實(shí)現(xiàn)精確分子治療。圖1. 超聲機(jī)械響應(yīng)型HOFs的制備這項(xiàng)工作研究了HOF納米晶體作為機(jī)械響應(yīng)平臺(tái)的前景�,展示了HOF材料能夠通過超聲編程并且進(jìn)行調(diào)控HOF骨架結(jié)構(gòu)的方式選擇性的激活(圖1a)�����。這項(xiàng)工作選擇氫鍵和芳環(huán)密度不同的四種OMBUs(有機(jī)分子結(jié)構(gòu)單元,organic molecular building units)��,合成了四種多孔HOF納米晶體�����,HOF-TATB���,HOF-BTB�,HOF-101����,HOF-102(圖1b)。合成使用沉淀法,通過動(dòng)態(tài)光散射(DLS)和TEM表征驗(yàn)證得到HOF納米晶體��。測(cè)試結(jié)果表明HOF的尺寸為250-500 nm��,多分散指數(shù)為0.2-0.3����。在HOF-101和HOF-102中���,含有四個(gè)羧酸的OMBUs形成了方形拓?fù)鋵訝罱Y(jié)構(gòu)���。通過π-π堆疊����,相鄰的2D方形層形成含有1D菱形通道的3D晶體(圖1b)�。通過粉末XRD表征驗(yàn)證了HOF-BTB、HOF-101����、HOF-102的晶體結(jié)構(gòu)��。 HOF-TATB是之前未曾報(bào)道的新型結(jié)構(gòu),因此通過微晶體電子衍射(microED)確定其結(jié)構(gòu)����。HOF-TATB內(nèi)的H3TATB OMBUs通過氫鍵和π-π堆疊��,自組裝形成雙重互穿3D氫鍵(3,4)-網(wǎng)狀結(jié)構(gòu)。當(dāng)去除客體分子甲醇�,HOF-TATB沿著b軸方向呈1D通道結(jié)構(gòu)�,通道的尺寸為12.2×23.9 ?,晶體內(nèi)的溶劑可及比例達(dá)到50.3 %���,這個(gè)結(jié)果表明HOF-TATB具有優(yōu)異的載藥應(yīng)用前景。通過粉末XRD表征��,HOF-TATB納米晶體晶體的純度��,并且具有長(zhǎng)達(dá)1周的水解穩(wěn)定性��。通過77 K的氮?dú)馕綄?shí)驗(yàn)和195 K的二氧化碳吸附實(shí)驗(yàn),驗(yàn)證四種HOF都具有多孔結(jié)構(gòu)���。測(cè)試超聲切斷溶液相中的HOF納米晶體。測(cè)試超聲處理過程中��,不同時(shí)間的骨架切斷程度(圖2a-d)���。在超聲作用下��,OMBUs從HOFs中切斷并溶解,離心得到的上層清液確認(rèn)含有溶解的OMBUs�����,通過UV-Vis光譜表征計(jì)算超聲處理過程中OMBUs切斷的比例�����。表征的結(jié)果表明��,不同結(jié)構(gòu)的HOF在超聲處理過程中達(dá)到特征性的解離平衡。 在1.5 MHz的超聲波和8.04 MPa的功率下,HOF-TATB,HOF-BTB���,HOF-101,HOF-102的平衡解離分別達(dá)到91.8%����,45.3%���,11.6%�,4.7%����。這個(gè)結(jié)果表明超聲驅(qū)動(dòng)HOF解離是熱力學(xué)過程。但是���,在100 ℃加熱5 min后,沒有發(fā)現(xiàn)HOF產(chǎn)生解離���,說明這些HOF具有非常高的熱穩(wěn)定性。因此����,打破分子間非共價(jià)化學(xué)鍵并且導(dǎo)致骨架解離的驅(qū)動(dòng)力來自超聲而非熱量。HOFs材料展示了優(yōu)異的超聲編程機(jī)械活化性能����,只有當(dāng)超聲功率達(dá)到一定的數(shù)值才可能激活HOF���,超聲能量的閾值與OMBUs有關(guān)(圖2a-d)����。超聲驅(qū)動(dòng)HOF解離以及編程解離機(jī)理�����。通過DFT理論計(jì)算研究HOFs的結(jié)構(gòu)-性質(zhì)關(guān)系��,計(jì)算內(nèi)聚能(Ecohesive),結(jié)果表明溶液中的HOF-TATB,HOF-BTB,HOF-101�,HOF-102的內(nèi)聚能從低到高�,因此這些HOFs的穩(wěn)定性逐漸增加(圖2e)�。在超聲驅(qū)動(dòng)HOF解離過程中,超聲場(chǎng)能夠影響反應(yīng)的自由能,因此In(k)隨著超聲功率的改變而變化(k��,HOF的解離平衡常數(shù))�����。反應(yīng)建模的結(jié)果表明ln(k)與Ecohesive之間具有線性關(guān)系���,因此能夠推測(cè)不同ln(k)時(shí)所需的最低Ecohesive���。此外���,本研究發(fā)現(xiàn)最小Ecohesive與超聲峰值壓力(EUS)之間具有線性關(guān)系�����。通過ln(k)與Ecohesive以及Ecohesive與EUS之間的現(xiàn)象關(guān)系,開發(fā)了三變量模型�,解釋這些變量之間的關(guān)系���。通過圖2f熱圖能夠預(yù)測(cè)在特定的超聲功率���,HOF解離所需的Ecohesive�,因此為設(shè)計(jì)超聲驅(qū)動(dòng)藥物活化HOF提供指導(dǎo)���。通過模型���,能夠預(yù)測(cè)HOF-TATB�,HOF-BTB,HOF-101����,HOF-102所需的理論超聲功率的閾值分別為0.07��,0.82,4.55�����,7.33 MPa(圖2e)���。其中���,當(dāng)OMBU的氫鍵數(shù)量增加���,能夠顯著增強(qiáng)HOF納米晶體的超聲穩(wěn)定性��。總之,機(jī)械化學(xué)鍵解離更容易對(duì)弱鍵構(gòu)成的骨架進(jìn)行解離���,因此對(duì)于含有的氫鍵數(shù)量更少、疇環(huán)芳香骨架結(jié)構(gòu)更少的HOF具有更高的超聲敏感性��。 這些HOF表現(xiàn)了優(yōu)異的藥物擔(dān)載量����。擔(dān)載量分別為HOF-TATB (15.1?±?1.4%),HOF-BTB (15.8?±?2.7%)�����,HOF-101 (27.0?±?1.5%)�����,HOF-102 (29.8?±?1.3%)�����。這種高藥物擔(dān)載量能夠減少輸送藥物載體的用量,因此最大化的減少可能的副作用�。通過染料分子釋放實(shí)驗(yàn)�,測(cè)試沒有超聲處理時(shí)的HOF納米晶體自由藥物釋放情況(圖2g)���。結(jié)果表明����,當(dāng)沒有超聲能量,HOF-TATB在3天后釋放的量只有5.5?±?0.1%。由于Ecohesive更高,HOF-BTB����,HOF-101����,HOF-102釋放的染料分子更少��,分別為1.9?±?0.9%�,1.2?±?0.2%���,0.1?±?0.1%�。超聲藥物釋放實(shí)驗(yàn)結(jié)果同樣表明,Ecohesive更低或者超聲功率增加�,具有更高的釋放量(圖2h,i)���,結(jié)果與理論預(yù)測(cè)相符(圖2f)����。 圖3. 超聲控制HOF-TATB納米晶釋放藥物分子以及體外調(diào)控神經(jīng)活動(dòng)HOF-TATB納米晶體對(duì)超聲最敏感�,具有最低的超聲功率激活藥物釋放,并且具有最合適的時(shí)間分辨率����。HOF-102納米晶體的穩(wěn)定性最高�,藥物擔(dān)載量最高��。為了對(duì)深層大腦實(shí)現(xiàn)高分辨率的超聲控制釋放���,采用HOF-TATB以盡量的減少超聲功率��。在擔(dān)載藥物后,HOF-TATB納米晶體的粒徑和形貌沒有變化(圖3a)。測(cè)試發(fā)現(xiàn)能夠在臨床安全范圍內(nèi)的超聲功率(1.5 MHz,1.5 MPa)釋放藥物,并且沒有超聲的情況下不會(huì)產(chǎn)生藥物釋放(圖3b)��。超聲活化閾值為0.51 MPa�����,隨著超聲功率增加,釋放的分子增加(圖3c)。此外��,通過10 s脈沖的重復(fù)性刺激�����,HOF-TATB能夠重復(fù)性的釋放染料分子���,因此能夠以四種不同的量釋放�����,分別為10.2?±?1.3%,5.0?±?3.0%��,6.5?±?5.2%���,10.0?±?4.4%(圖3d)�。此外,HOF展示了作為一種普適性的超聲編程藥物遞送體系�����,通過超聲編程激活釋放各種藥物��。比如����,去氯氯氮平(deschloroclozapine��,一種具有前景的遺傳藥物)����、多巴胺(dopamine��,重要的神經(jīng)遞質(zhì),與帕金森病的成癮和治療有關(guān))�、普魯卡因(procaine��,一種止疼劑)都能夠擔(dān)載到HOF中,分別實(shí)現(xiàn)9.7?±?0.9?wt%��,7.8?±?0.5?wt%,4.8?±?1.2?wt%的擔(dān)載量��,并且能夠通過超聲實(shí)現(xiàn)按需釋放����。通過溶血測(cè)試(haemolysis)和細(xì)胞活力測(cè)試(cell viability tests),驗(yàn)證HOF-TATB沒有表現(xiàn)毒性或者溶血性��,因此具有生物安全性����。這個(gè)結(jié)果表明HOF-TATB納米晶能夠作為普適性的生物兼容性和生物安全的藥物遞送平臺(tái)。 化學(xué)遺傳學(xué)(Chemogenetics)使用工程G-蛋白偶聯(lián)受體用于激活特定藥物結(jié)合的神經(jīng)元���,因此這種方式具有獨(dú)特的長(zhǎng)期神經(jīng)調(diào)節(jié)能力,而且比光遺傳學(xué)相比具有最小的致免疫性��。傳統(tǒng)的化學(xué)遺傳學(xué)技術(shù)通常受限于脫靶問題�����,并且因?yàn)樗幋鷦?dòng)力學(xué)導(dǎo)致的時(shí)間分辨率較低�����。為了解決這些困難與挑戰(zhàn),這項(xiàng)研究能夠精確的激活設(shè)計(jì)藥物分子CNO���,因此實(shí)現(xiàn)對(duì)深部腦區(qū)實(shí)現(xiàn)高時(shí)間分辨率。使用HOF-TATB納米晶體擔(dān)載CNO藥物分子����,隨后超聲激活釋放CNO藥物,激活神經(jīng)元內(nèi)由設(shè)計(jì)藥物激活的受體(圖3e)�����。精確的定時(shí)激活靶向神經(jīng)元對(duì)于研究大腦活動(dòng)與行為之間的關(guān)系非常關(guān)鍵���。因此�����,通過光纖測(cè)量法(fibre photometry)評(píng)估超聲-化學(xué)遺傳學(xué)對(duì)小鼠的中腦腹側(cè)被蓋區(qū)(VTA)的神經(jīng)元進(jìn)行實(shí)時(shí)激活的性質(zhì)(VTA區(qū)域是非常重要的調(diào)節(jié)獎(jiǎng)勵(lì)學(xué)習(xí)和抑郁的區(qū)域)�。使用1.4 MPa的超聲功率能夠在VTA區(qū)域產(chǎn)生0.9 MPa的超聲功率�����,這個(gè)能量足以激活釋放CNO(圖3c)��。對(duì)VTA區(qū)域的神經(jīng)元使用病毒進(jìn)行單側(cè)神經(jīng)轉(zhuǎn)導(dǎo),隨后第4周后仍然在相同區(qū)域注射TATB@CNO(圖4a,b)。結(jié)果表明���,通過對(duì)VTA區(qū)域施加超聲,發(fā)現(xiàn)成功的產(chǎn)生激活(圖4c,d)。超聲-化學(xué)遺傳學(xué)方法表現(xiàn)高時(shí)間分辨率,超聲刺激3.5 s延遲后激活神經(jīng)(圖4e)�。此外����,通過控制實(shí)驗(yàn)驗(yàn)證超聲處理和TATB@CNO納米晶體激活VTA的神經(jīng)(圖4f,g)�。基于對(duì)VTA觀測(cè)發(fā)現(xiàn)的神經(jīng)激活��,測(cè)試了超聲-化學(xué)遺傳學(xué)方法調(diào)節(jié)小鼠獎(jiǎng)勵(lì)學(xué)習(xí)行為的能力(圖4h)�����,測(cè)試小鼠強(qiáng)迫游泳實(shí)驗(yàn)的影響(圖4l)�����。圖4. 超聲化學(xué)遺傳學(xué)(sono-chemogenetic)體內(nèi)刺激小鼠深部腦圖5. 超聲化學(xué)遺傳學(xué)(sono-chemogenetic)體內(nèi)刺激大鼠深部腦 除了測(cè)試小鼠之外�����,對(duì)大鼠同樣進(jìn)行體內(nèi)超聲-化學(xué)遺傳學(xué)腦深部刺激測(cè)試(圖5)���。因?yàn)樾∈蟾?,更便宜,有更多研究類型。大鼠具有更厚的頭骨,更大的腦組織,因此更符合臨床的需求�����。對(duì)大鼠的測(cè)試結(jié)果表明�����,超聲-化學(xué)遺傳學(xué)能夠?qū)Υ笫蟮拇竽X深部進(jìn)刺激�,而且通過非侵入式刺激深層大腦����,能夠有效的調(diào)節(jié)獎(jiǎng)勵(lì)-學(xué)習(xí)行為。這項(xiàng)工作展示了超聲激活的HOF材料體系���,通過超聲控制分子化學(xué)結(jié)構(gòu)之間的相互作用,實(shí)現(xiàn)了分子尺度精確調(diào)控相互作用���。HOF作為具有弱分子間氫鍵和弱π-π相互作用的3D多孔骨架材料,使得具有溶液相可調(diào)控的穩(wěn)定性�,較高的分子擔(dān)載量���,超聲控制HOF解離的能力�。超聲能量作為驅(qū)動(dòng)力能夠進(jìn)行編程����,設(shè)計(jì)分子內(nèi)的非共價(jià)鍵剪切力�����,因此實(shí)現(xiàn)了機(jī)械力學(xué)活化�。通過調(diào)節(jié)氫鍵的密度和疇環(huán)芳烴的數(shù)量����,發(fā)展了能夠解釋HOF的結(jié)構(gòu)和功能之間關(guān)系的理論模型,為按需和編程進(jìn)行理性和精確的HOF設(shè)計(jì)提供可能���。由于HOF材料具有的以上優(yōu)勢(shì),打開了通過超聲進(jìn)行時(shí)間分辨激活且編程激活藥物�,為非侵入式神經(jīng)控制和醫(yī)療診療技術(shù)提供機(jī)會(huì)����,比如化學(xué)遺傳學(xué)調(diào)控神經(jīng)回路�。通過調(diào)節(jié)HOF納米晶體對(duì)超聲的敏感度,成功的實(shí)現(xiàn)了小鼠和大鼠的深層腦神經(jīng)回路在數(shù)秒內(nèi)的時(shí)間空間分辨率控制。這個(gè)研究結(jié)果表明超聲處理HOF能夠?qū)崿F(xiàn)時(shí)間分辨和長(zhǎng)期性的神經(jīng)調(diào)控的超聲-化學(xué)遺傳學(xué),而且能夠盡量減少侵入式危害����。這項(xiàng)研究將超聲HOF技術(shù)能夠?qū)⑺幬飺?dān)載�����、生物穩(wěn)定性、低致免疫性��、超聲編程結(jié)合���,因此達(dá)到非侵入式的精確醫(yī)療�。超聲HOF技術(shù)能夠以按照設(shè)計(jì)的靈敏度和分辨率釋放不同類型的分子。因此能夠精確和非侵入的控制深層組織的各種細(xì)胞事件����。這項(xiàng)工作作為一種精確的非侵入式分子控制技術(shù),有可能應(yīng)用于可編程分子機(jī)器人用于深層組織細(xì)胞事件的復(fù)雜控制���。 Wang, W., Shi, Y., Chai, W. et al. H-bonded organic frameworks as ultrasound-programmable delivery platform. Nature (2025).DOI: 10.1038/s41586-024-08401-0https://www.nature.com/articles/s41586-024-08401-0