
細胞焦亡是一種由gasdermin (GSDM) 介導的程序性炎癥細胞死亡。它通過在質膜上形成孔隙并觸發促炎細胞因子的分泌來啟動炎癥反應,為癌癥免疫治療帶來希望。已報道了許多誘導細胞焦亡的藥物,包括離子、小分子治療藥物和納米材料,突顯了它們激活癌細胞焦亡的潛力。然而,這些藥物中的大多數對癌細胞缺乏選擇性,可能在正常組織中誘導細胞焦亡,導致全身毒性。最近,光動力療法已成為誘導癌細胞焦亡的一種特定方法。這種光子控制的細胞焦亡有可能克服與傳統細胞焦亡誘導劑相關的副作用和耐藥性。盡管如此,由于光在生物組織中的穿透深度有限以及腫瘤微環境的缺氧性質,對光照射和氧氣的需求限制了對深層腫瘤及其轉移的療效。迫切需要一種有效的焦亡誘導劑,它不需要光和氧氣,并選擇性地誘導焦亡殺死深層腫瘤和轉移。
超分子相互作用參與了許多調節生命所必需的細胞功能的關鍵生物過。在活細胞內直接合成超分子已成為控制細胞功能和操縱細胞命運的通用策略。具體而言,合成的小分子化合物在癌細胞溶酶體內受控自組裝成超分子結構已被證明可有效治療癌。通過引起不可逆的溶酶體膜通透性 (LMP),溶酶體內的超分子結構可誘導溶酶體功能障礙和溶酶體細胞死亡,使其能夠有效克服交叉耐藥性。據報道,各種能夠組裝成超分子結構的小分子化合物作為 LMP 誘導劑,大多由兩親性肽結構組成,其序列源自天然蛋白。由于溶酶體含有負責蛋白質降解和清除的各種蛋白酶,肽組裝體易被溶酶體蛋白酶水解。這可能會降低它們在溶酶體中的穩定性并損害其治療癌癥的功效。此外,這些肽組裝體主要通過凋亡相關途徑誘導癌細胞死亡,而凋亡途徑通常會抑制炎癥,導致對“冷”腫瘤的免疫反應較弱。控制溶酶體合成具有高穩定性和效力的超分子結構,以促進選擇性癌細胞焦亡,隨后引發強大的抗腫瘤免疫反應,這是一個持續的挑戰。
成果簡介
近日,南京大學的葉德舉團隊介紹了一種新型腫瘤特異性納米顆粒(NP-NH-D5),該顆粒能夠通過破壞溶酶體來激活細胞焦亡,為癌癥免疫治療提供了新的思路。NP-NH-D5能夠在腫瘤細胞溶酶體中發生負電荷到正電荷的轉變,并從納米顆粒轉變為納米纖維,這一過程通過響應細胞外基質金屬蛋白酶-2(MMP-2)和細胞內還原劑(如谷胱甘肽GSH)實現。形成的非肽納米纖維能夠高效破壞溶酶體,觸發Gasdermin-D(GSDMD)介導的細胞焦亡,從而誘導強烈的免疫原性細胞死亡(ICD),并改善免疫抑制性腫瘤微環境。體內實驗表明,NP-NH-D5能夠有效抑制原位4T1乳腺腫瘤的生長,防止轉移和復發,并延長生存期,且無系統性副作用。此外,它還能顯著增強PD-L1抗體免疫治療的效果,尤其在4T1晚期肺轉移和侵襲性原位Pan02胰腺腫瘤模型中表現出色。
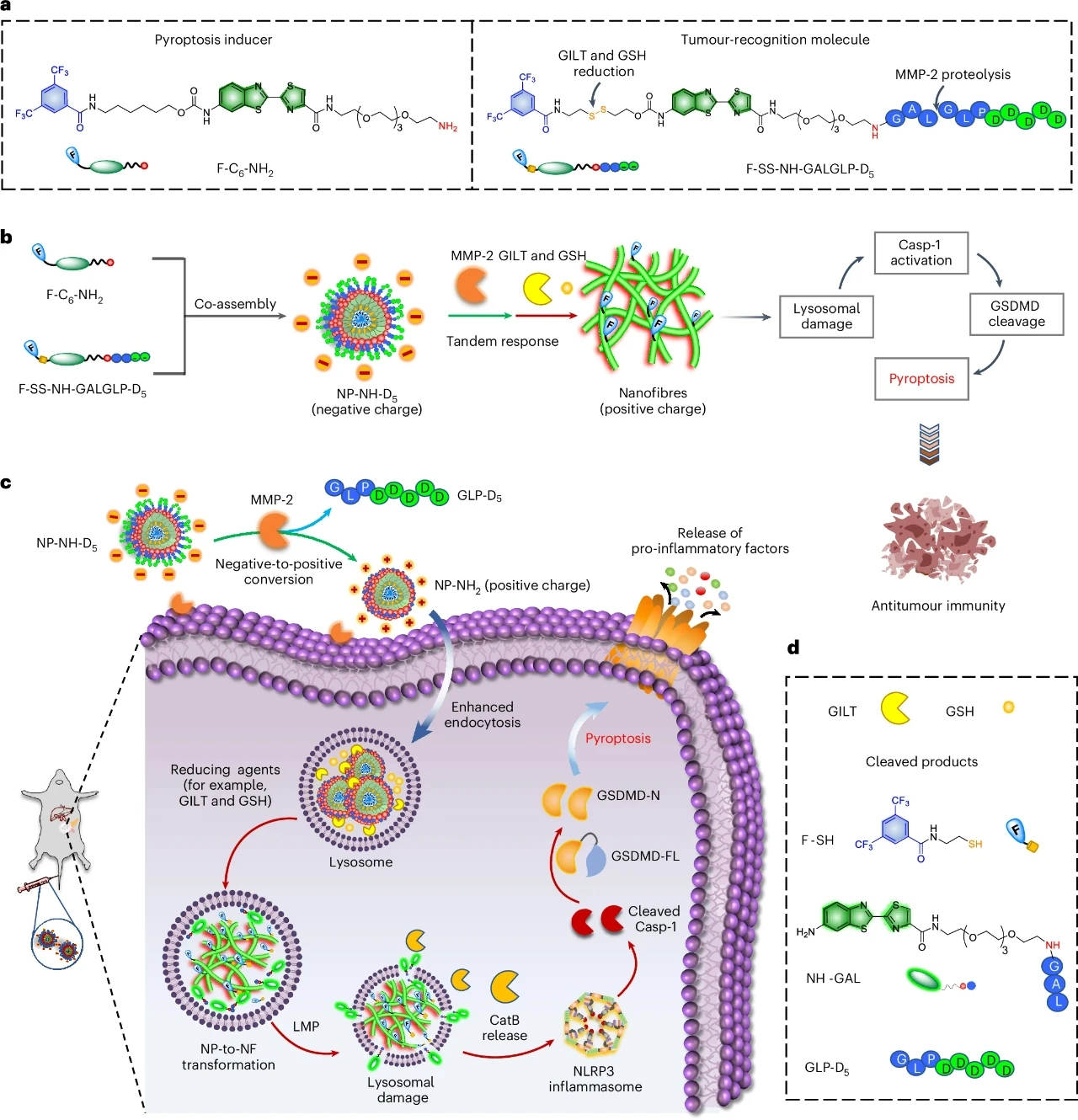
圖 1 | NP-NH-D5誘導焦亡和抗腫瘤免疫反應的示意圖
F-C6-NH2的設計、合成及其自組裝為納米纖維
研究團隊設計了一種非肽類小分子兩親化合物F-C6-NH2,其核心設計目標是能夠在細胞內自組裝成剛性納米纖維(NFs)。F-C6-NH2由四個關鍵部分組成:疏水的3,5-二(三氟甲基)苯基、C6烷基鏈、氨基氧雜熒光素(AO-Luc)熒光團和帶有伯胺基團的聚乙二醇(PEG3)連接鏈。其中,3,5-二(三氟甲基)苯基提供了強大的分子間疏水相互作用和氫鍵潛力,增強了F-C6-NH2的自組裝穩定性和整體穩定性;C6烷基鏈對內源性還原劑(如GSH)具有抵抗力,確保了分子在生物環境中的穩定性;AO-Luc熒光團不僅通過π-π堆疊和范德華力促進自組裝,還能發出綠色熒光,便于實時監測F-C6-NH2的動態變化;PEG3連接鏈則平衡了分子的親水性,伯胺基團有助于氫鍵的形成和溶酶體內的積累。
實驗中,F-C6-NH2在PBS緩沖液中表現出良好的自組裝能力,其臨界組裝濃度約為9.3μM。通過動態光散射(DLS)和透射電子顯微鏡(TEM)分析,研究團隊發現F-C6-NH2能夠快速形成小球形納米顆粒和短納米纖維,并逐漸生長為平均直徑約12nm的長納米纖維。原子力顯微鏡(AFM)進一步確認了納米纖維的形成,其平均高度約為3nm,且具有較高的楊氏模量(平均值為464±75MPa),表明納米纖維具有較高的剛性。此外,F-C6-NH2的自組裝過程還通過圓二色光譜(CD)得到了驗證,顯示出典型的β-折疊結構特征。
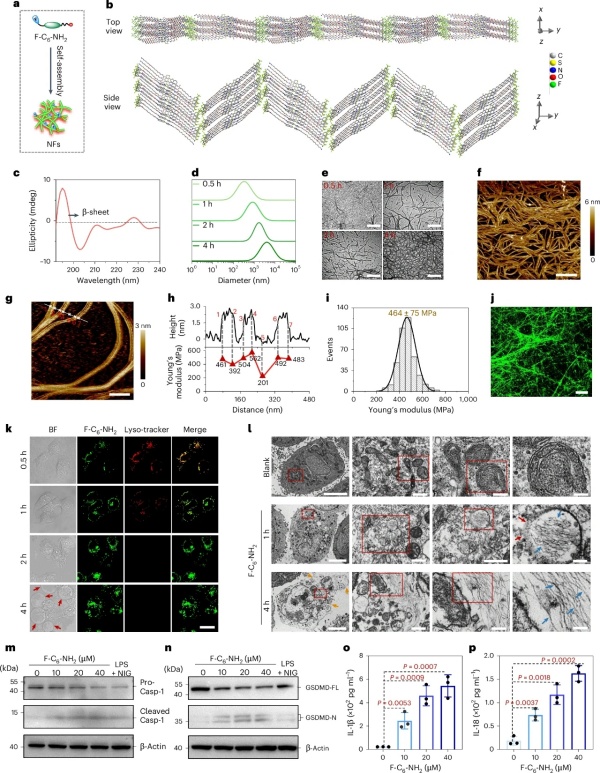
圖 2 | F-C6-NH2自組裝成納米纖維的表征
F-C6-NH2自組裝成納米纖維并誘導GSDMD介導的焦亡
實驗結果表明,F-C6-NH2能夠進入HeLa或4T1細胞,并主要在溶酶體中積累。隨著時間推移,溶酶體的熒光信號逐漸消失,而F-C6-NH2的熒光信號保持明亮,表明溶酶體膜已被破壞。通過生物透射電子顯微鏡(Bio-TEM)分析,研究團隊觀察到F-C6-NH2處理的HeLa細胞溶酶體中出現了密集的納米纖維,溶酶體膜顯示出明顯的破裂跡象。隨著時間延長,納米纖維進入細胞質,細胞出現腫脹和嚴重的溶酶體損傷,最終導致細胞死亡。
此外,F-C6-NH2在HeLa和4T1細胞中表現出濃度依賴性的細胞毒性,其半數抑制濃度(IC50)分別為2.40±0.14μM和4.05±0.12μM。相比之下,其他對照化合物(如F-SS-NH2、F-C6-NHAc等)在50μM時幾乎無細胞毒性。這表明F-C6-NH2的細胞毒性主要來源于其在溶酶體內的自組裝過程。進一步的實驗通過Western blot分析和免疫熒光確認了成熟貓眼蛋白酶B(CatB)從溶酶體釋放到細胞質中,激活了NLRP3炎癥體,導致Caspase-1的剪切和GSDMD的裂解。這些結果表明,F-C6-NH2能夠通過破壞溶酶體膜,誘導GSDMD介導的細胞焦亡,并釋放促炎細胞因子(如IL-1β和IL-18),從而激活免疫反應。
NP-NH-D5的設計與制備:一種腫瘤特異性焦亡誘導劑
為了提高F-C6-NH2對腫瘤細胞的選擇性,研究團隊進一步設計了一種腫瘤靶向納米顆粒NP-NH-D5。NP-NH-D5通過共組裝F-C6-NH2和F-SS-NH-GALGLP-D5制備而成,后者含有一個二硫鍵和一個可被MMP-2剪切的肽段。這種設計使得NP-NH-D5能夠響應細胞外的MMP-2和細胞內的還原劑(如GSH和GILT),從而實現從負電荷納米顆粒到正電荷納米纖維的轉變。
實驗中,NP-NH-D5在生理條件下表現出良好的穩定性,其粒徑約為60nm,表面電位為-4.39±1.52mV。當暴露于MMP-2時,NP-NH-D5的粒徑減小至約55nm,表面電位增加至+25.58±1.40mV。進一步的高分辨率質譜(HPLC)和圓二色光譜分析確認了MMP-2對F-SS-NH-GALGLP-D5的剪切作用,以及隨后在GSH或GILT作用下二硫鍵的還原反應。最終,NP-NH-D5在細胞內成功轉化為納米纖維,誘導溶酶體膜破裂和細胞焦亡。
NP-NH-D5選擇性誘導腫瘤細胞中的GSDMD介導的焦亡
NP-NH-D5在多種腫瘤細胞(如4T1、HeLa和A549)中表現出良好的細胞攝取能力,但在MMP-2缺陷的正常細胞(如GES-1)中則無明顯攝取。這表明NP-NH-D5能夠通過MMP-2介導的剪切作用特異性地進入腫瘤細胞。進一步的實驗通過HPLC分析確認了NP-NH-D5在腫瘤細胞內的代謝過程,檢測到了F-C6-NH2和NH-GAL等代謝產物。
細胞實驗結果表明,NP-NH-D5能夠顯著抑制多種腫瘤細胞的生長,其IC50值在不同腫瘤細胞系中有所不同,但均低于正常細胞系。此外,NP-NH-D5處理的腫瘤細胞表現出典型的焦亡特征,如細胞腫脹、膜泡形成和GSDMD的裂解。Western blot分析進一步確認了Caspase-1的激活和GSDMD的裂解,表明NP-NH-D5能夠通過激活NLRP3炎癥體和GSDMD介導的焦亡途徑,誘導腫瘤細胞死亡。
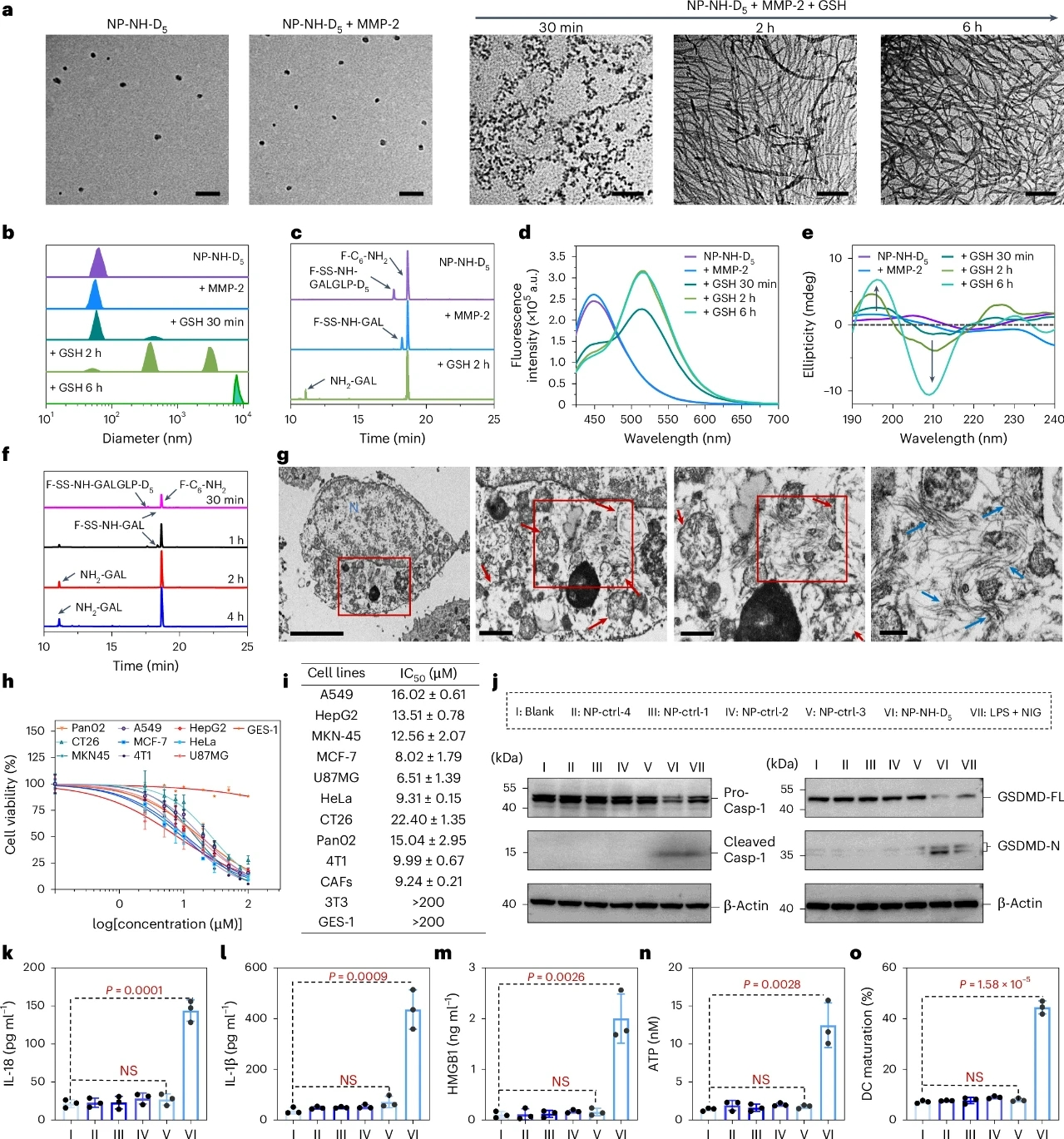
圖 3 | NP-NH-D5體外及細胞培養中的表征
NP-NH-D5在體內誘導焦亡以實現抗腫瘤免疫
為了評估NP-NH-D5在體內抗腫瘤免疫治療中的效果,研究團隊在原位4T1乳腺腫瘤模型中進行了實驗。實驗結果表明,NP-NH-D5在腫瘤組織中具有良好的富集能力,其熒光信號在注射后8小時達到峰值,且顯著高于對照組。治療結果顯示,NP-NH-D5能夠顯著抑制腫瘤生長,減少肺轉移,并延長小鼠的生存期。組織學分析進一步確認了NP-NH-D5處理的腫瘤組織中存在大量納米纖維和溶酶體損傷,表明NP-NH-D5在體內能夠有效誘導細胞焦亡。
此外,NP-NH-D5處理的腫瘤組織中促炎細胞因子(如IL-1β和IL-18)的水平顯著升高,這有助于激活樹突狀細胞(DC)的成熟和T細胞的浸潤。流式細胞術分析表明,NP-NH-D5能夠顯著增加腫瘤組織中CD4+和CD8+ T細胞的浸潤,同時減少調節性T細胞(Treg)的比例。這些結果表明,NP-NH-D5不僅能夠誘導腫瘤細胞焦亡,還能通過激活免疫系統,實現對腫瘤的有效抑制。
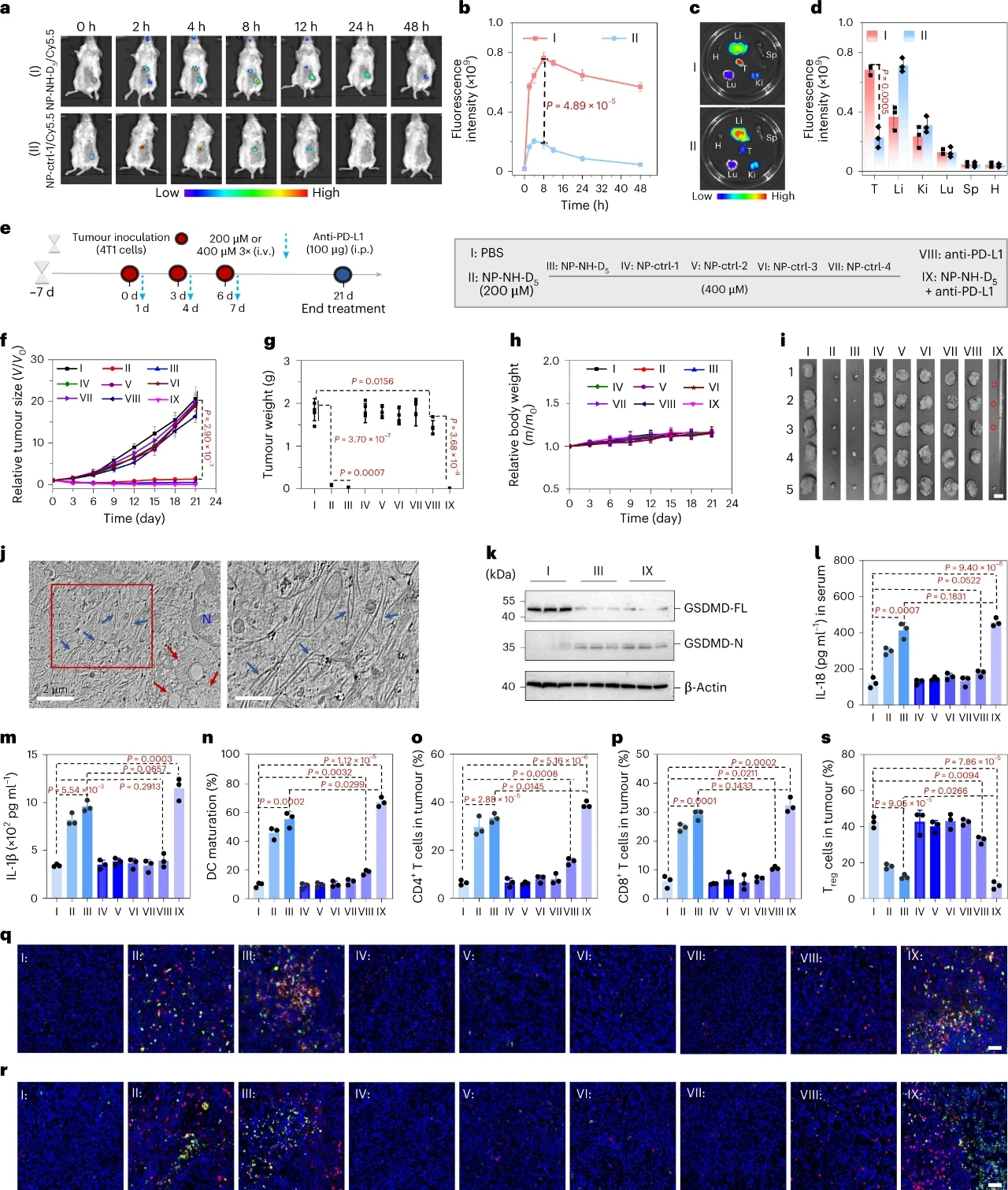
圖 4 | NP-NH-D5在原位4T1腫瘤小鼠模型中誘導抗腫瘤免疫反應
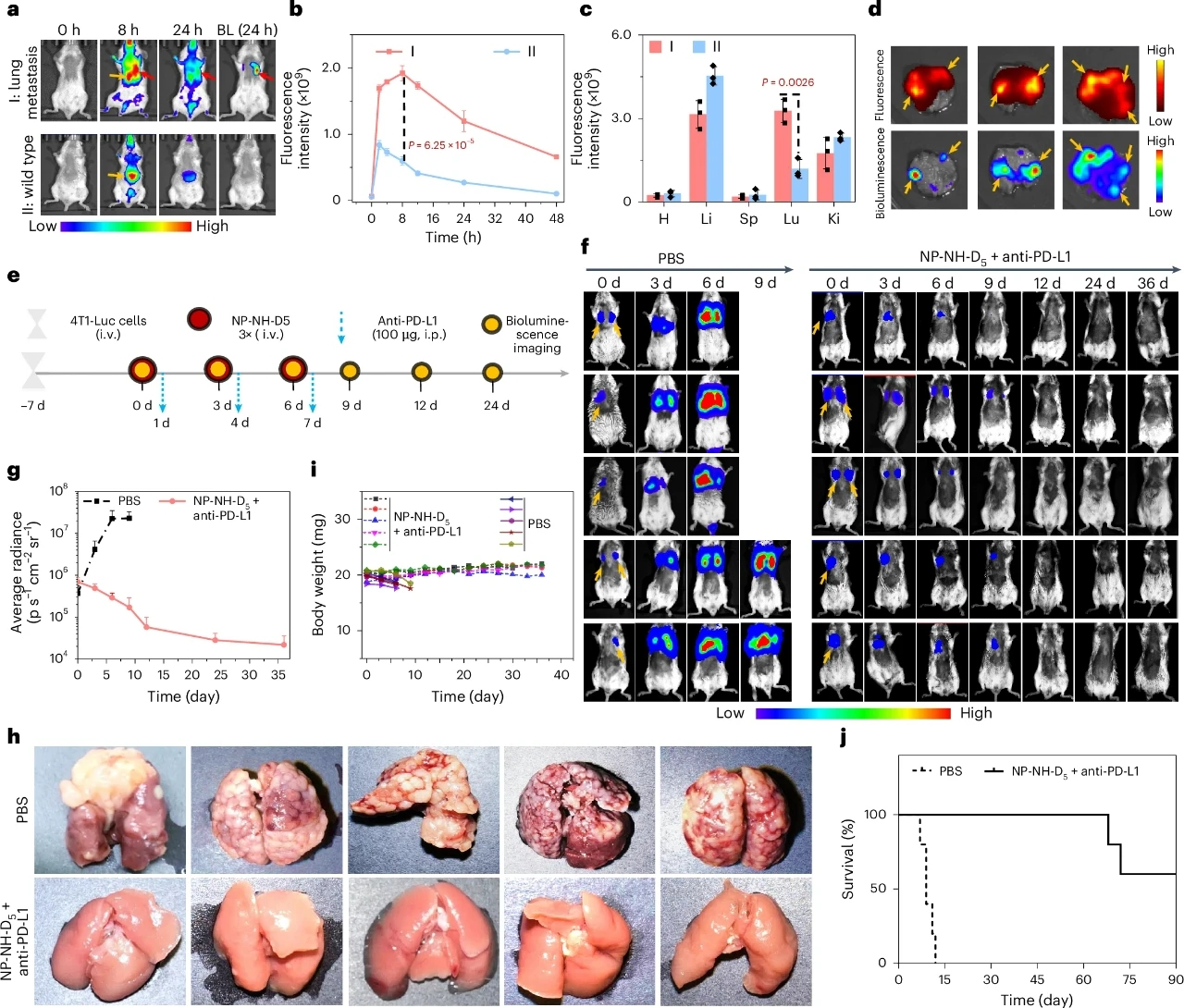
圖 5 | NP-NH-D5聯合抗PD-L1有效清除4T1晚期肺轉移瘤
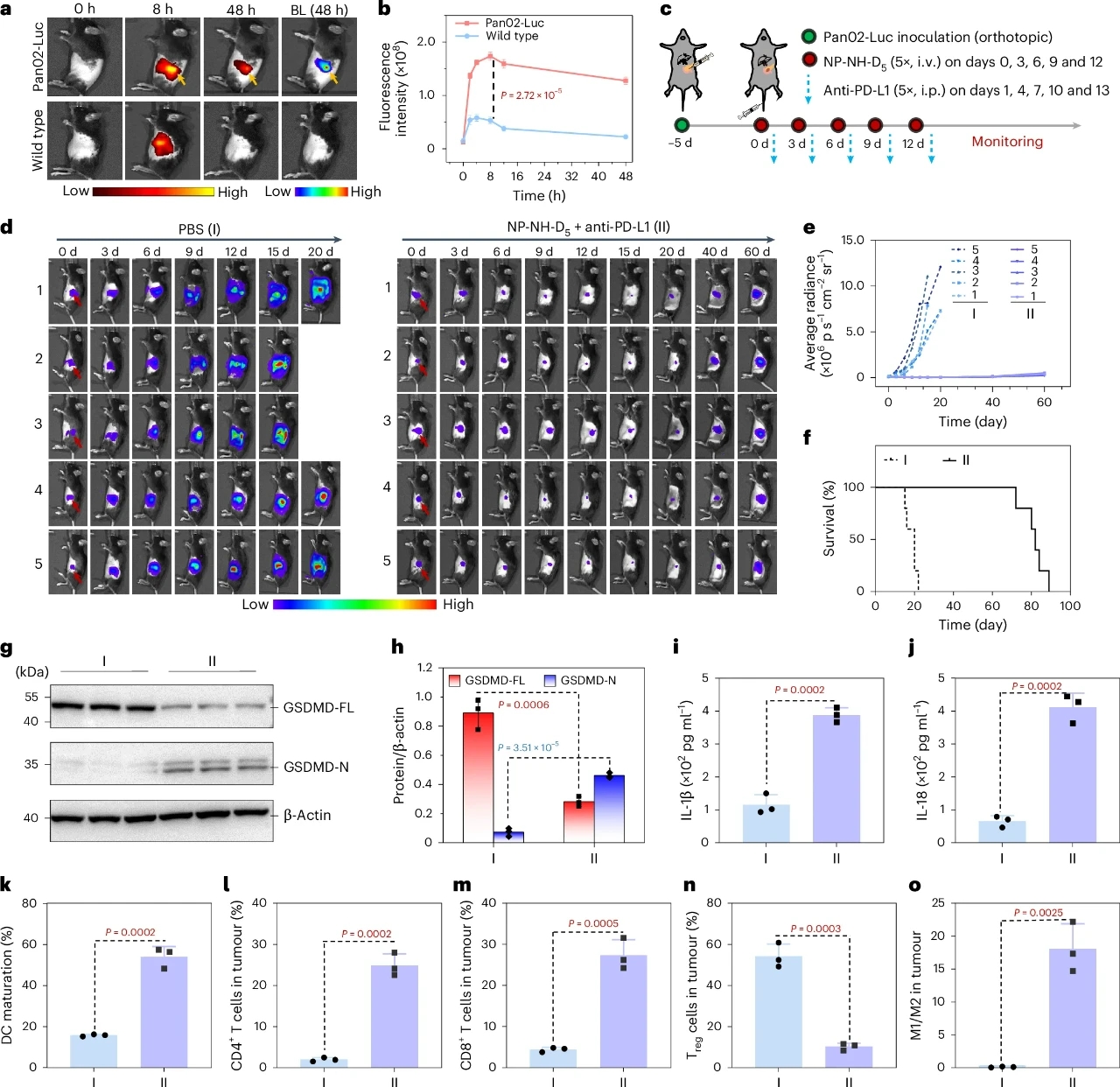
圖 6 | NP-NH-D5聯合抗PD-L1抑制原位Pan02胰腺腫瘤
小結
本研究開發的NP-NH-D5納米顆粒為癌癥免疫治療提供了一種全新的策略。通過在腫瘤細胞溶酶體中特異性自組裝成納米纖維,NP-NH-D5能夠高效破壞溶酶體膜,誘導GSDMD介導的細胞焦亡,并激活強烈的免疫原性細胞死亡反應。體內實驗進一步證實了NP-NH-D5在抑制腫瘤生長、防止轉移和延長生存期方面的顯著效果。此外,NP-NH-D5與PD-L1抗體聯合使用時,能夠進一步增強免疫治療的效果,為臨床應用提供了廣闊前景。未來,NP-NH-D5有望與其他化療藥物和免疫調節劑聯合使用,克服耐藥性問題,提高癌癥治療的整體效果。
參考文獻:
Zhang, J., Hu, Y., Wen, X. et al. Tandem-controlled lysosomal assembly of nanofibres induces pyroptosis for cancer immunotherapy. Nat. Nanotechnol. (2025).
https://doi.org/10.1038/s41565-025-01857-9











