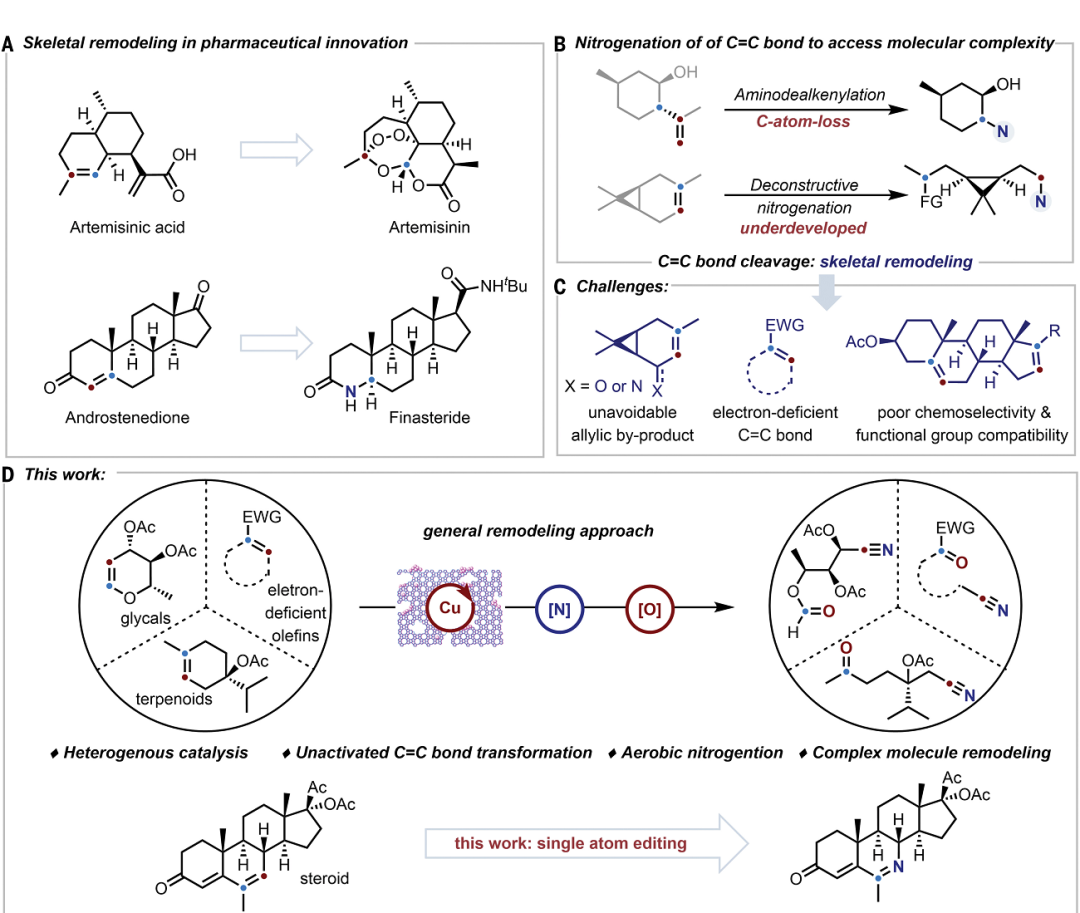
C=C雙鍵的打破和轉(zhuǎn)化是合成化學(xué)和藥物化學(xué)領(lǐng)域的重要策略,雖然通過烯烴復(fù)分解和臭氧化反應(yīng)切斷C=C雙鍵在合成天然產(chǎn)物中得到顯著進(jìn)展,但是仍然缺乏合適的方法切斷C=C雙鍵對分子進(jìn)行結(jié)構(gòu)重構(gòu)。
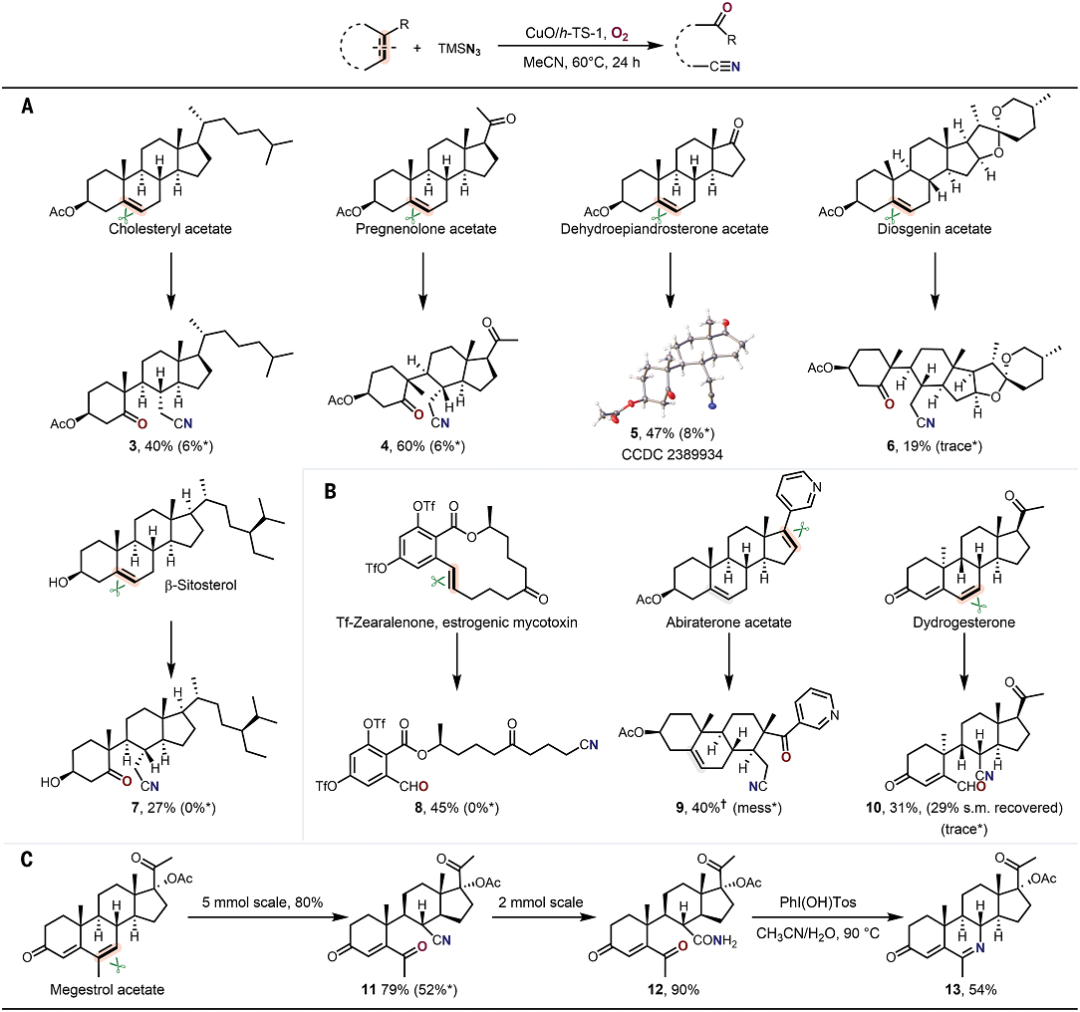
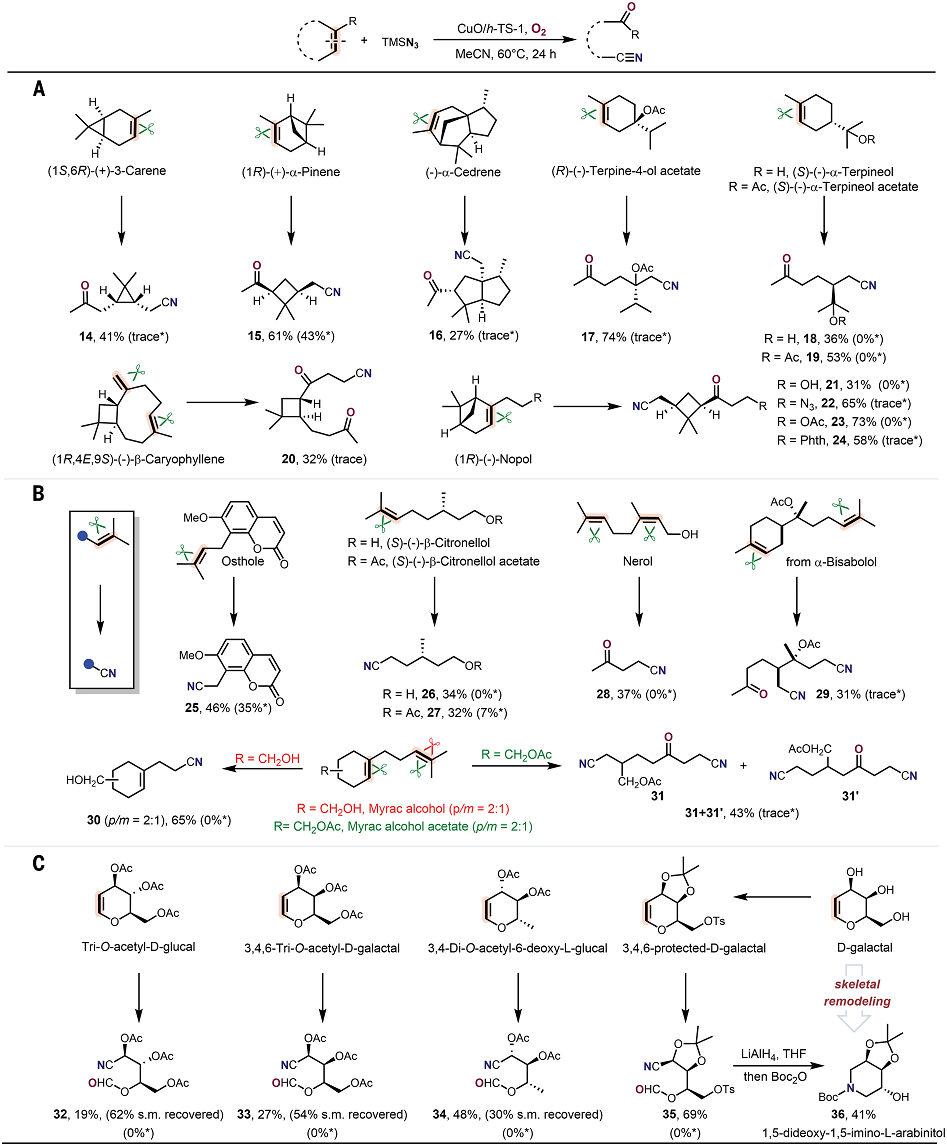
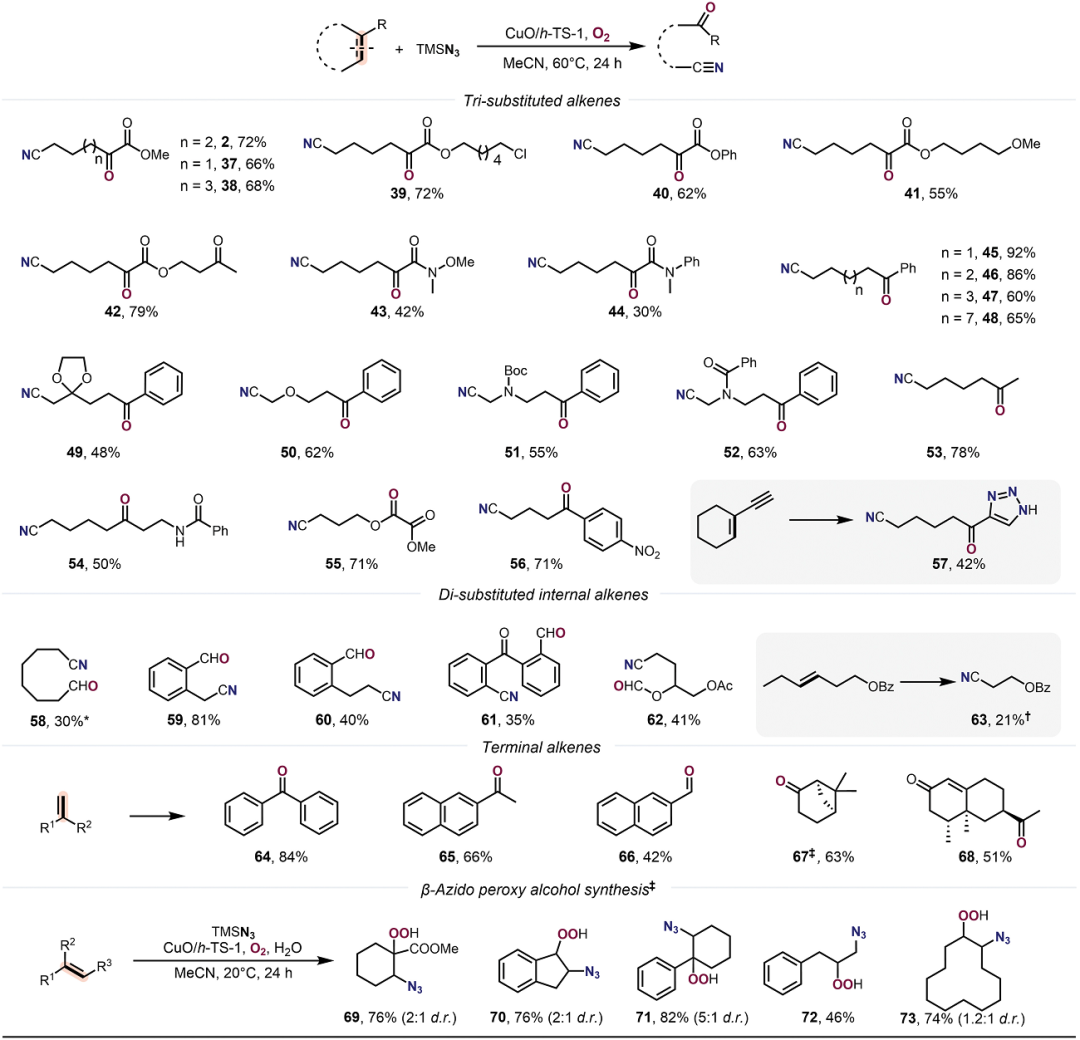
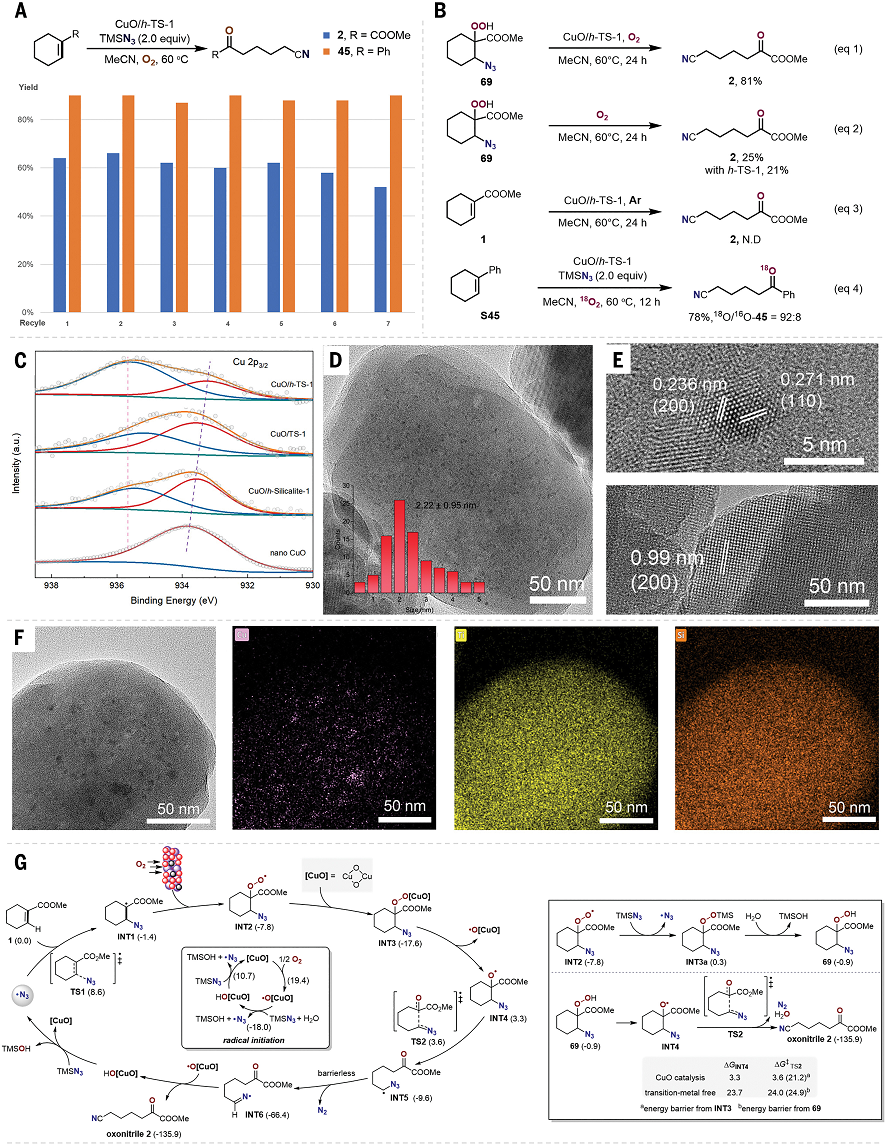
有鑒于此,北京大學(xué)焦寧教授、中石化石油化工科學(xué)研究院夏長久等報(bào)道異相Cu催化切斷C=C雙鍵的策略,能夠?qū)?fù)雜結(jié)構(gòu)分子之中C=C雙鍵任意一側(cè)的碳原子轉(zhuǎn)化為羰基和氰基,因此對復(fù)雜分子實(shí)現(xiàn)結(jié)構(gòu)重構(gòu)。 這個方法能夠非常有效的將萜類化合物、糖基、類固醇和生物活性化合物轉(zhuǎn)化為結(jié)構(gòu)未深入研究的分子結(jié)構(gòu)。這項(xiàng)工作設(shè)計(jì)了一種可重復(fù)使用的異相Cu催化劑(CuO/h-TS-1),在有氧條件下對C=C雙鍵進(jìn)行氮化,實(shí)現(xiàn)了合成高附加值的含氮/含氧化合物(圖1D)。作者能夠轉(zhuǎn)化多種多樣的C=C雙鍵,包括缺電子烯烴、結(jié)構(gòu)復(fù)雜有機(jī)分子中的C=C雙鍵。這種方法能夠?qū)⒁酝鶡o法通過TEMPO催化反應(yīng)轉(zhuǎn)化,將C=C雙鍵轉(zhuǎn)化為C=O雙鍵和C≡N三鍵。此外,開發(fā)了一種對天然產(chǎn)物和復(fù)雜結(jié)構(gòu)化合物的創(chuàng)新切斷C=C雙鍵進(jìn)行結(jié)構(gòu)重構(gòu)的策略。目前人們對于切斷C-C化學(xué)鍵進(jìn)行氧化(oxygenation)和氮化(nitrogenation)策略的關(guān)注,因此希望開發(fā)切斷C=C雙鍵對復(fù)雜結(jié)構(gòu)分子進(jìn)行結(jié)構(gòu)重構(gòu),合成氧腈化合物(oxonitriles)。 但是,之前報(bào)道的TEMPO催化反應(yīng)策略存在三個明顯缺點(diǎn):(i)難以對缺電子烯烴進(jìn)行親電疊氮自由基加成、(ii)反應(yīng)的兼容性非常差,無法對結(jié)構(gòu)復(fù)雜烯烴(類固醇和萜類化合物)的結(jié)構(gòu)修飾、(iii)催化劑無法回收。為了解決這個缺點(diǎn),作者提出高效催化劑需要能夠活化疊氮自由基,并且避免自由基犧牲劑。因此,基于這個想法,篩選過渡金屬催化劑。反應(yīng)條件。對缺電子烯烴1分子測試有氧氮化反應(yīng)。首先,TEMPO和NHPI作為自由基引發(fā)劑和自由基終止劑無法在TMSN3和O2存在下,催化1轉(zhuǎn)化為氧氮化合物(Table S1,entry 1和2)。使用CoCl2、MgBr2、CuCl2、FeCl2、CuO作為催化劑,只能以較低的產(chǎn)率得到2(Table S1,entry 3-7)。納米粒徑CuO(<50 nm)比塊體CuO表現(xiàn)更好的催化活性(Table S1,entry 7 vs. entry 8)。以上結(jié)果表明活性中心的分散性有助于改善催化劑的性能。因此,設(shè)計(jì)合成一系列過渡金屬催化劑修飾在分子篩載體之中的催化劑(Table S1)。其中,CuO/TS-1催化劑生成2的產(chǎn)率達(dá)到64%(Table S1,entry 9)。Fe-氧化物、Co-氧化物、Mn-氧化物修飾的TS-1分子篩無法催化反應(yīng)(Table S1,entry 10-12)。將CuO擔(dān)載到多級結(jié)構(gòu)TS-1(CuO/h-TS-1)之中,得到最好的催化活性,以76%的收率生成2(Table S1,entry 17)。復(fù)雜結(jié)構(gòu)分子的結(jié)構(gòu)重構(gòu)天然產(chǎn)物的優(yōu)勢結(jié)構(gòu)(privileged scaffolds)具有獨(dú)特的化學(xué)多樣性和生物相關(guān)性,因此是藥物發(fā)現(xiàn)領(lǐng)域處于基礎(chǔ)性地位。但是,這些天然產(chǎn)物化合物通常含有豐富的sp3碳和氧原子,以及豐富的氫鍵供體受體,較少的氮原子。因此,氮原子在藥物化學(xué)領(lǐng)域非常重要,但是將含氮官能團(tuán)引入天然分子骨架的方法學(xué)非常缺乏。 含氮原子官能團(tuán)的類固醇分子相比于不含氮原子的結(jié)構(gòu)相比,能夠表現(xiàn)許多功能增強(qiáng),包括抗菌、抗病毒、抗炎和抗癌活性。在最優(yōu)的反應(yīng)條件下,對含有C=C雙鍵的類固醇化合物進(jìn)行有氧氮化反應(yīng)(圖2A)。發(fā)現(xiàn)這個方法能夠阻礙C-7位點(diǎn)的不利性的烯丙基氧化,選擇性合成一系列其他方法無法得到的高附加值B環(huán)修飾5,6-立體結(jié)構(gòu)類固醇化合物(3-7)。 通過X射線晶體表征驗(yàn)證5的結(jié)構(gòu)。在合適的反應(yīng)條件下,能夠切斷生成其衍生化的結(jié)構(gòu)(圖2B,8-10)。這種方法能夠?qū)蠧=C雙鍵的萜類化合物進(jìn)行結(jié)構(gòu)重構(gòu)(圖3)。對(1S, 6R)-(+)-3-蒈烯(carene)氧化切斷C=C雙鍵生成順式-環(huán)丙烷14,產(chǎn)率為41%。類似的,含有環(huán)丁烷結(jié)構(gòu)的(1R)-(+)-α-蒎烯(pinene)、(1R)-(–)-諾卜醇(nopol)能夠轉(zhuǎn)化為手性環(huán)丁烷結(jié)構(gòu),并且含有羥基、疊氮、酯、酰胺官能團(tuán)(15,21-24)。(–)-α-雪松烯(cedrene)能夠方便的合成結(jié)構(gòu)復(fù)雜雙環(huán)[3.3.0]辛烷骨架(16),這個結(jié)果表明這項(xiàng)方法構(gòu)筑手性環(huán)丙烷、環(huán)丁烷、環(huán)戊烷和各種官能團(tuán)的復(fù)雜分子。(R)-(–)-4-萜品醇乙酸酯以及衍生物能夠以適中的產(chǎn)率得到含有手性季碳的氧腈化合物(17-19)。(1R, 4E, 9S)-(–)-β-石竹烯(caryophyllene)能夠轉(zhuǎn)化為反式取代環(huán)丁烷衍生物20。這些反應(yīng)通過TEMPO催化反應(yīng)方法難以進(jìn)行。 由于氰基在設(shè)計(jì)藥物化合物中的重要作用,因此研究萜類化合物的末端異丁烯結(jié)構(gòu)氮化(圖3C)。對蛇床子素、(S)-(–)-β-香茅醇(citronellol)、橙花醇(nerol)、α-紅沒藥醇(bisabolol)等化合物切斷一個或兩個C=C雙鍵能夠合成非環(huán)狀烷基腈化合物(25-29)。Myrac alcohol醇以及酯切斷一個或兩個C=C雙鍵能夠生成30,31,31′。糖烯(glycals)能夠轉(zhuǎn)化為修飾氰基的甲酸酯(32-34)。并且通過TEMPO催化反應(yīng)過程完全無法進(jìn)行該反應(yīng)。該反應(yīng)能夠通過切斷C=C化學(xué)鍵高效率將D-半乳糖烯轉(zhuǎn)化為1,5-二脫氧-1,5-亞氨基-L-阿拉伯糖醇(圖3C)。這項(xiàng)方法除了能夠轉(zhuǎn)化結(jié)構(gòu)復(fù)雜分子,也能夠用于結(jié)構(gòu)簡單分子的重構(gòu)(圖4)。對于修飾三個取代基的環(huán)狀烯烴,環(huán)的尺寸和官能團(tuán)(苯、鹵、醚、羰基)對反應(yīng)效率并沒有明顯影響,并且許多缺電子烯烴能夠很好的轉(zhuǎn)化為氧腈化物(2,37-44)。切斷苯基環(huán)己烯或者更大的環(huán)狀烯烴能夠以較高的收率生成長鏈氧腈化合物(45-48)。此外,環(huán)己烯骨架修飾酸敏感縮酮官能團(tuán)的反應(yīng)物能夠以合適的產(chǎn)率生成49。此外,二氫呋喃、N保護(hù)的1,2,3,6-四氫吡啶、修飾烷基的環(huán)己烯(50-55)能夠方便的轉(zhuǎn)化。缺電子芳基取代修飾環(huán)戊烯以71 %的產(chǎn)率生成56。CuO/h-TS-1通過打破C=C雙鍵和隨后的C≡C點(diǎn)擊反應(yīng),能夠以42 %收率生成四唑化合物57。 隨后,對修飾雙取代基的烯烴(環(huán)辛烯、茚、二氫萘、5-二苯并辛烯酮)在標(biāo)準(zhǔn)反應(yīng)條件生成氧腈化合物(58-61)。3,4-二氫-2H-吡喃生成修飾氰基取代基的甲酸酯(62),惰性的線性脂肪烯烴轉(zhuǎn)化為相應(yīng)的產(chǎn)物(63)。此外,除了這種環(huán)狀烯烴,該反應(yīng)能夠?qū)⒍讼N轉(zhuǎn)化為酮或者醛(64-68)。此外,在20 ℃和水存在的情況下進(jìn)行反應(yīng),烯烴1的C=C雙鍵不會被切斷,但是能夠生成β-疊氮基過氧醇(69)。此外,該催化反應(yīng)的優(yōu)點(diǎn)是CuO/h-TS-1能夠回收,并且不會產(chǎn)生明顯損失。比如,在重復(fù)7次催化反應(yīng)之后,CuO/h-TS-1催化劑的催化活性未見明顯衰減(圖5A)。控制實(shí)驗(yàn)研究反應(yīng)機(jī)理。如圖5B,69反應(yīng)使用CuO/h-TS-1和h-TS-1轉(zhuǎn)化反應(yīng)的產(chǎn)率達(dá)到81%和21%。此外,當(dāng)沒有加入催化劑,在O2氣氛中,69部分轉(zhuǎn)化為2產(chǎn)物(圖5B,eq 1-2)。這說明CuO/h-TS-1起到主要的作用(圖5B,eq 3)。此外,反應(yīng)在Ar氣氛中無法發(fā)生。以18O2標(biāo)記,18O-45同位素標(biāo)記實(shí)驗(yàn)得到78%產(chǎn)率(圖5B,eq 4)。 為了深入理解CuO/h-TS-1的催化反應(yīng)性能,進(jìn)行多種表征實(shí)驗(yàn)。通過XPS表征Cu的氧化態(tài)(圖5C),發(fā)現(xiàn)CuO/h-S-1、CuO/TS-1、CuO/h-TS-1的氧化態(tài)都是+2價(jià)態(tài)。此外,通過TEM表征CuO顆粒在h-TS-1內(nèi)的分布均勻性,結(jié)果表明樣品沒有塊體CuO或者較大CuO納米粒子(圖5C-F)。h-TS-1的豐富多孔結(jié)構(gòu)有助于分子篩內(nèi)的擴(kuò)散傳質(zhì)。通過DFT理論計(jì)算研究反應(yīng)機(jī)理,發(fā)現(xiàn)反應(yīng)的關(guān)鍵是Cu促進(jìn)切斷O-O化學(xué)鍵的步驟(圖5G)。這項(xiàng)研究為構(gòu)筑更加豐富化學(xué)空間用于拓展合成化學(xué)和藥物發(fā)現(xiàn)領(lǐng)域提供強(qiáng)有力的策略。Zengrui Cheng et al. , Catalytic remodeling of complex alkenes to oxonitriles through C=C double bond deconstruction.Science387,1083-1090(2025).DOI: 10.1126/science.adq8918https://www.science.org/doi/10.1126/science.adq8918