研究背景
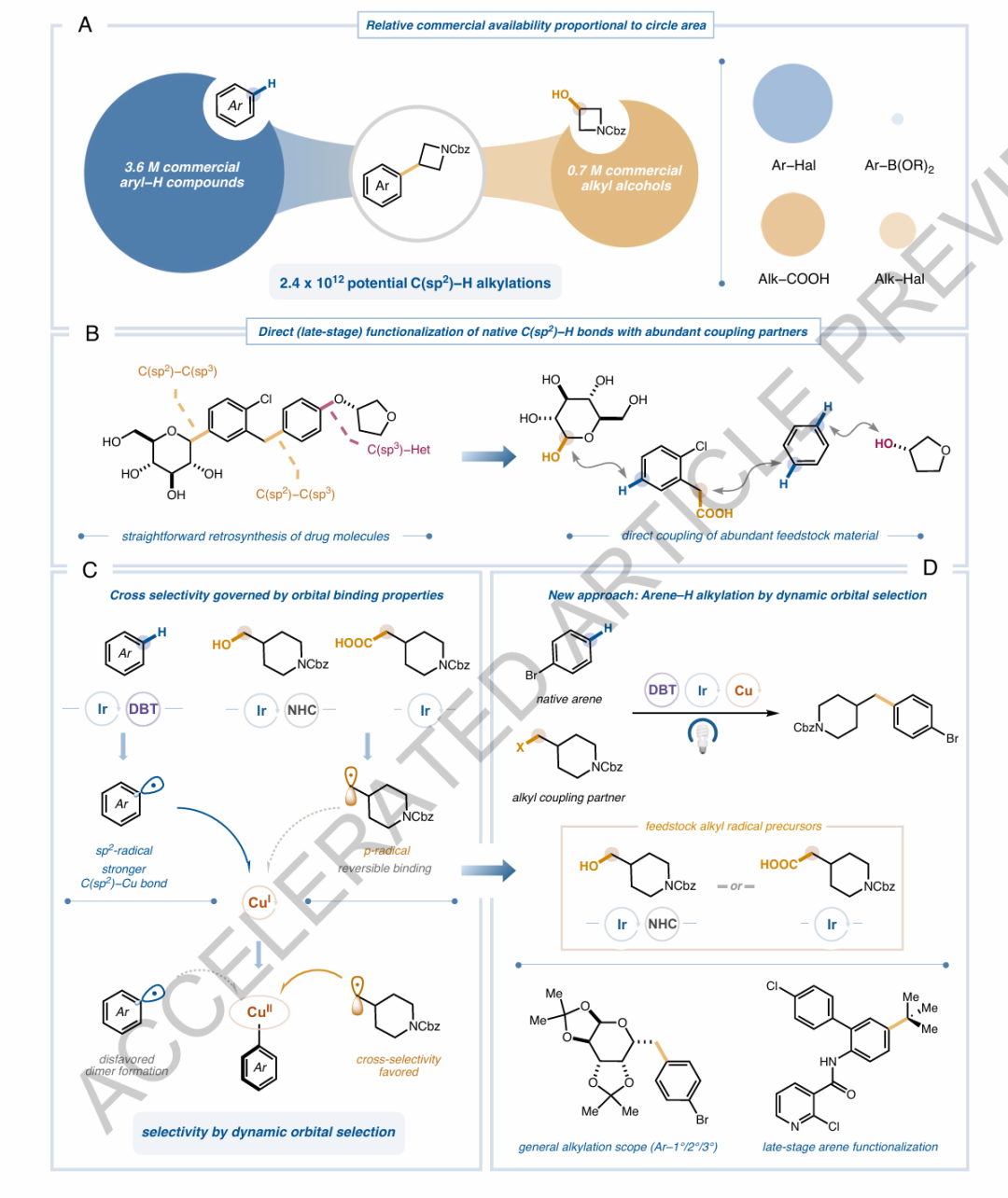
高效且模塊化的分子框架多樣化,特別是在藥物優化過程中合成多樣分子庫,仍然是一個重要的挑戰。由于其高的sp3特征和結構的多樣性,烷基片段的晚期引入尤其受歡迎。考慮到這些基團在分子框架中的普遍性,C(sp2)?H鍵成為了吸引人多樣化目標,盡管這一過程通常需要困難的預先官能化或冗長的從頭合成。傳統上,芳烴的直接烷基化通過采用Friedel–Crafts反應條件,使用強的Br?nsted或Lewis酸來實現。然而,這些方法存在功能基團耐受性差和選擇性低等問題,限制了它們在晚期官能化和藥物優化中的廣泛應用。在此,美國普林斯頓大學默克催化中心David W. C. MacMillan(2021年諾貝爾化學獎得主)教授團隊在“Nature”期刊上發表了題為“Generalizing arene C?H alkylations by radical?radical cross-coupling”的最新論文。該團隊報告了一種新策略,用于選擇性地偶聯不同雜化的自由基物種,研究者稱之為動態軌道選擇。這一機制性范式通過在位形成兩種不同的自由基物種,從而克服了Friedel-Crafts烷基化的常見限制,隨后通過銅基催化劑根據它們各自的結合特性進行區分。因此,研究者展示了一種普遍且高度模塊化的反應,用于使用豐富且無害的醇類和羧酸作為烷基化試劑,直接烷基化天然芳烴C?H鍵。最終,該解決方案克服了在藥物框架中以晚期方式引入復雜烷基框架的合成挑戰,從而提供了進入廣闊新化學空間的途徑。基于這一耦合機制的普遍性,動態軌道選擇預計將成為一個廣泛適用的耦合平臺,適用于涉及兩種不同自由基物種的進一步挑戰性轉化。
研究亮點
(1)實驗首次提出了動態軌道選擇機制,成功實現了芳烴C(sp2)?H鍵的直接烷基化。通過這一新策略,研究者克服了傳統Friedel-Crafts烷基化方法中常見的功能基團耐受性差和低選擇性等問題。(2)實驗通過在位形成兩種不同的自由基物種,并利用銅基催化劑根據自由基的結合特性對其進行區分,從而實現了選擇性偶聯。這一反應不僅使用了豐富且無害的醇類和羧酸作為烷基化試劑,還展示了高效且模塊化的反應體系。(3)結果表明,該策略能夠在復雜的藥物框架中成功引入烷基片段,并顯著擴大了可及的化學空間。通過這一方法,可以在藥物優化中實現高效的晚期官能化,避免了冗長的從頭合成過程。
圖文解讀
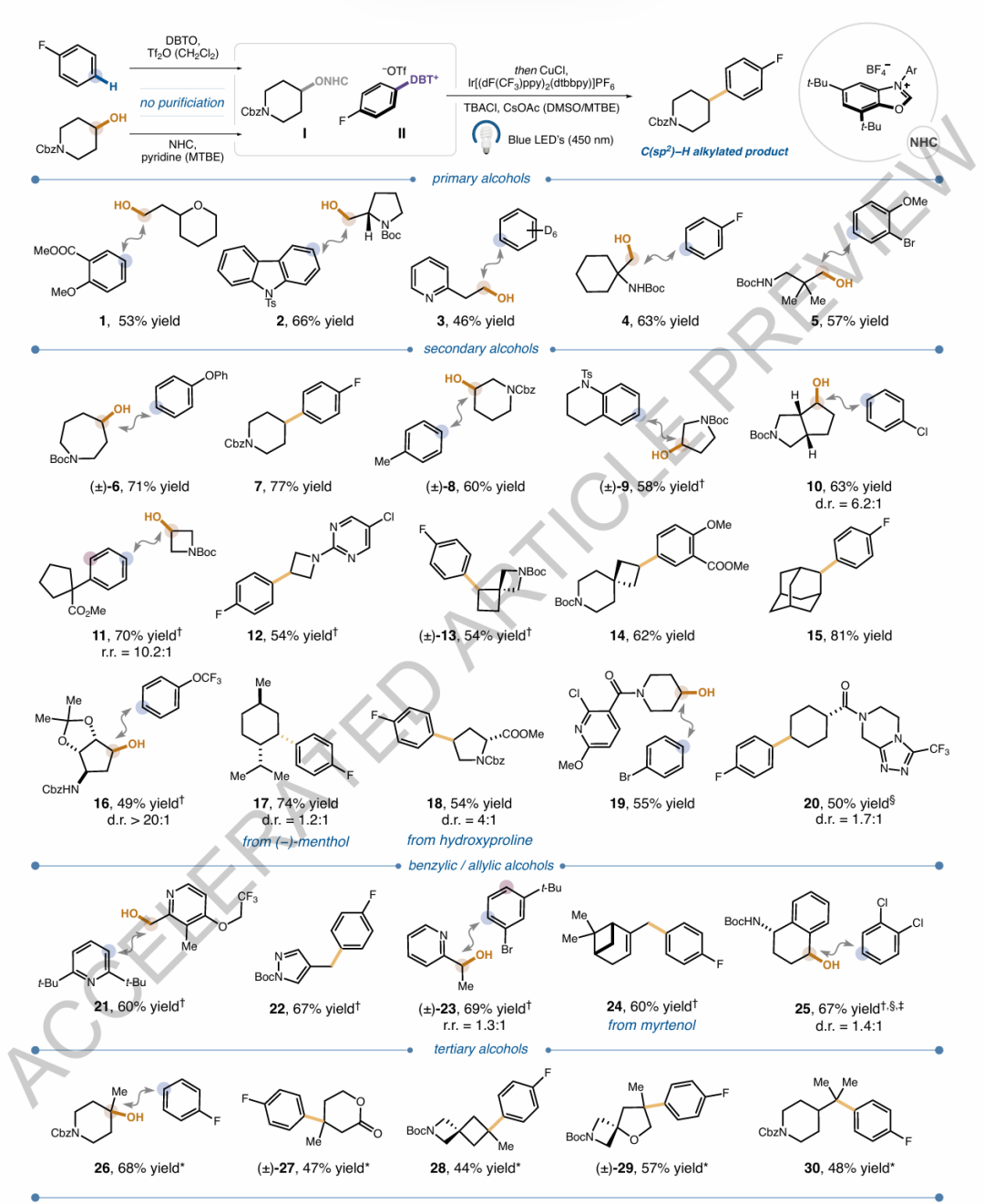
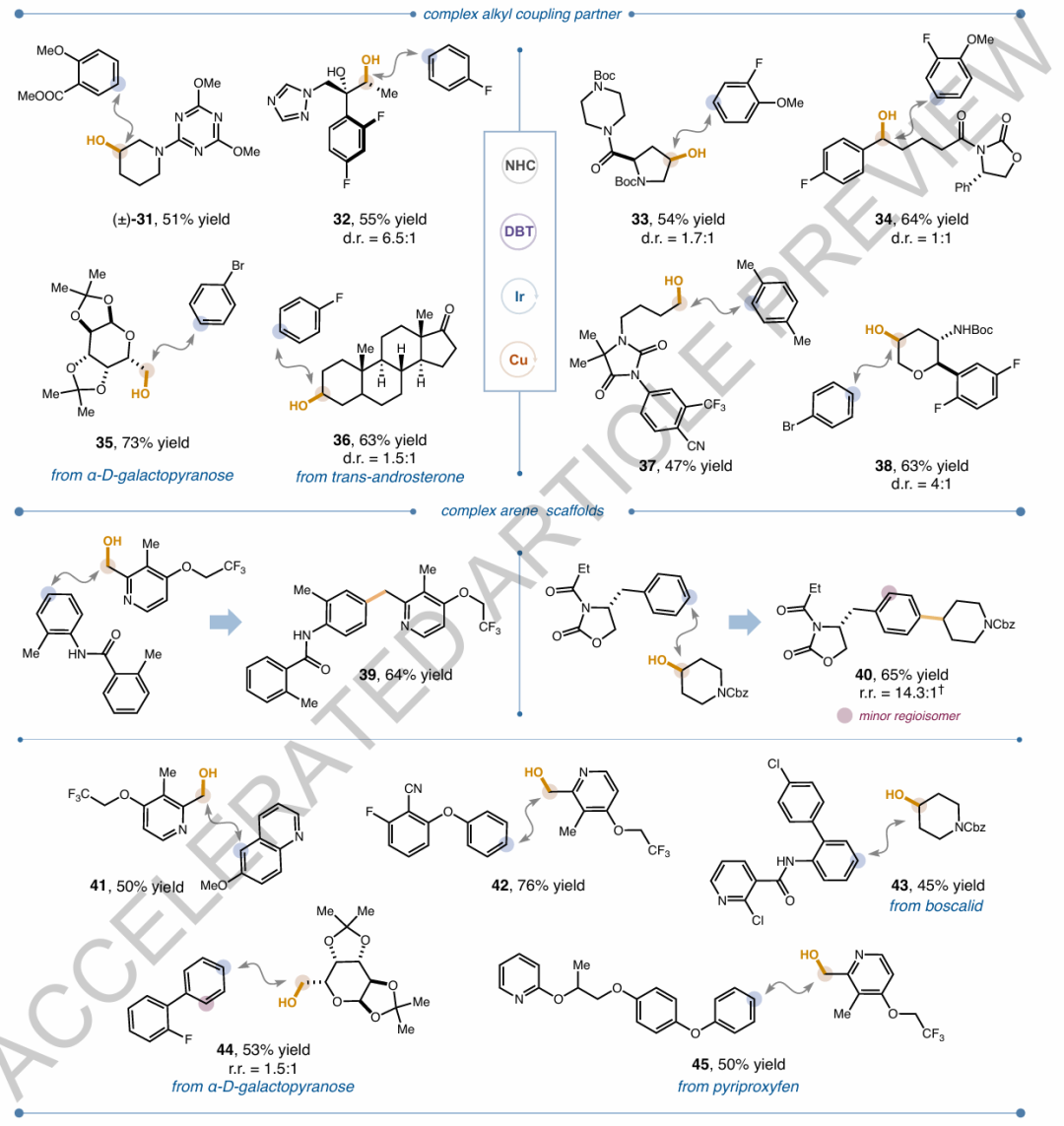
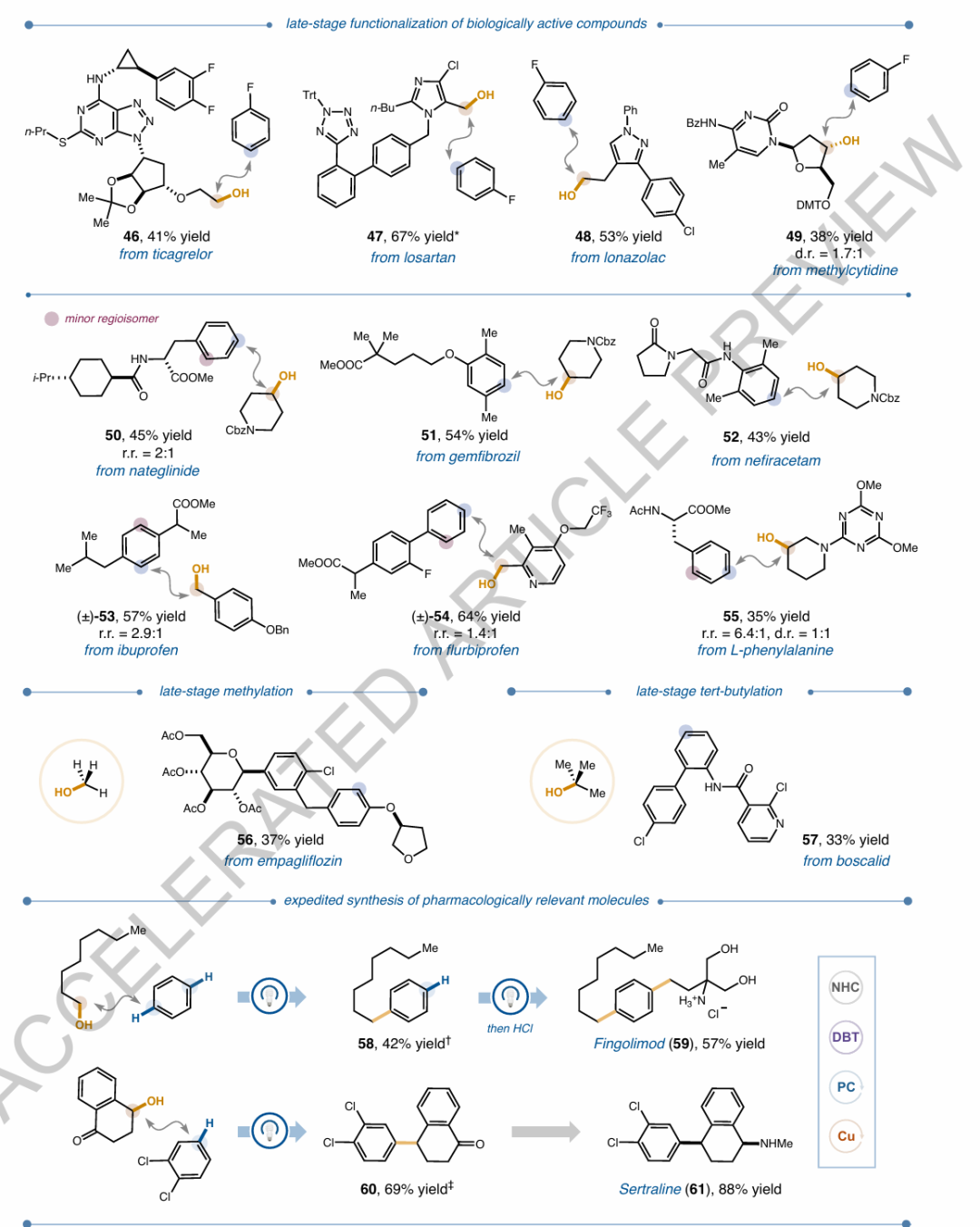
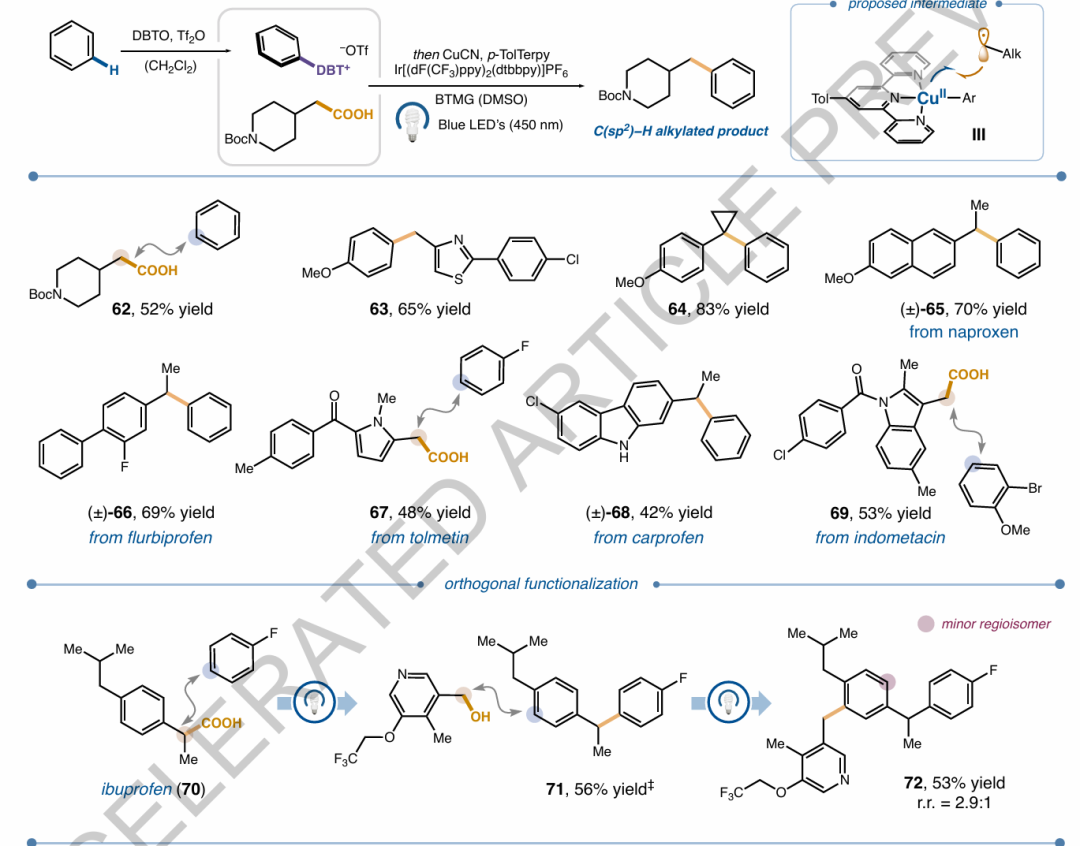
圖2. 芳烴與醇的自由基-自由基交叉偶聯反應的底物范圍圖5. 芳烴與羧酸的自由基-自由基交叉偶聯反應的底物范圍及正交官能團化
結論展望
總而言之,本文提出的動態軌道選擇機制為芳烴C(sp2)?H鍵的直接烷基化提供了一種全新的策略,克服了傳統Friedel-Crafts反應在選擇性和官能團耐受性上的限制。通過在反應中引入銅基催化劑,并利用自由基的軌道差異進行選擇性耦合,實驗成功實現了多種醇類和羧酸的高效烷基化反應,展現了在藥物分子晚期官能化中的廣泛應用潛力。這一方法不僅具有較高的模塊化和普適性,還能夠有效拓展化學空間,提供更多的結構多樣性,尤其是在復雜藥物分子的合成中顯示出巨大的優勢。此外,正交官能化策略的成功應用,使得現有藥物骨架可以通過模塊化操作實現更為精細的結構修飾,進一步推動了藥物優化的效率。本文的研究啟示研究者,在未來的藥物合成中,采用軌道選擇性的自由基交叉偶聯反應,可以為實現更高效、普適的分子多樣性和藥物開發提供新的思路與方法。 Gro?kopf, J., Gopatta, C., Martin, R.T. et al. Generalizing arene C?H alkylations by radical?radical cross-coupling. Nature (2025).https://doi.org/10.1038/s41586-025-08887-2