推薦閱讀:28歲評教授,38歲當院士!他,又發Science!
編輯總結
形成碳-碳鍵的反應是有機化學和藥物合成的基礎。盡管鈀催化在過去幾十年中一直是這一領域的重要工具,但近年來,人們越來越多地采用更豐富的鎳催化,并結合化學、光化學或電化學還原活化手段。本研究報道了一類不需要外部還原劑的磺酰肼反應物的應用。只需在鎳催化劑的作用下加熱,即可通過自由基途徑與烷基、烯基、炔基和芳基等多種基團形成碳-碳鍵。——Jake S. Yeston
研究背景
磺酰肼是一類穩定且通常為結晶態的物質,可以通過多種途徑獲得,包括通過腙的瞬時轉化,從而實現羰基化合物的凈還原芳基化。
鑒于此,斯克利普斯研究所Phil S. Baran教授團隊在Science期刊上發表了題為“Sulfonyl hydrazides as a general redox-neutral platform for radical cross-coupling”的最新論文。該團隊展示了它們作為多功能自由基前體的實用性,并通過七種碳-碳鍵形成的氧化還原中性交叉偶聯反應予以驗證。這些反應涉及活化烯烴、烷基鹵化物、氧化還原活性酯、芳基鹵化物、烯基鹵化物、炔基鹵化物及三氟甲基化試劑,從而構建 C(sp3)-C(sp3)、C(sp3)-C(sp2) 和 C(sp3)-C(sp) 鍵。
由于這些官能團兼具自由基前體和電子供體的雙重作用,因此不需要外加氧化還原(化學、光化學或電化學)添加劑。該均相反應在水相條件下進行,操作簡單,有助于簡化合成并實現溫和的末端官能化。
研究亮點
(1)實驗首次采用磺酰肼作為自由基前體,實現了無需外部還原劑的碳-碳鍵偶聯反應,成功構建了 C(sp3)-C(sp3)、C(sp3)-C(sp2) 和 C(sp3)-C(sp) 三種類型的碳-碳鍵。
(2)實驗通過鎳催化和簡單加熱條件,開發了一種氧化還原中性的交叉偶聯策略,使磺酰肼在均相水相條件下高效反應,無需額外的化學、光化學或電化學添加劑。
(3)實驗驗證了磺酰肼作為自由基前體和電子供體的雙重作用,成功將其應用于七類不同的交叉偶聯反應,包括與活化烯烴、烷基鹵化物、氧化還原活性酯、芳基鹵化物、烯基鹵化物、炔基鹵化物及三氟甲基化試劑的反應,展現了良好的底物適應性。
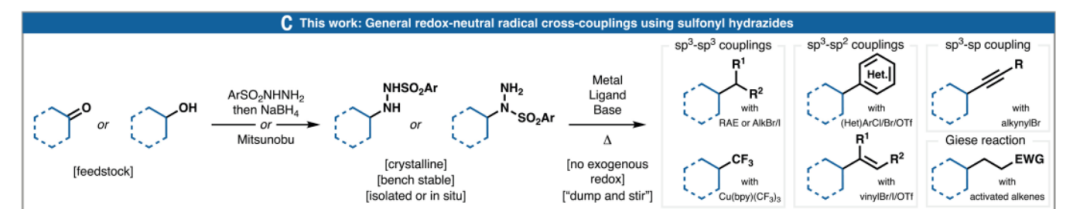
磺酰肼作為自由基交叉偶聯的通用氧化還原中性平臺
圖文解讀
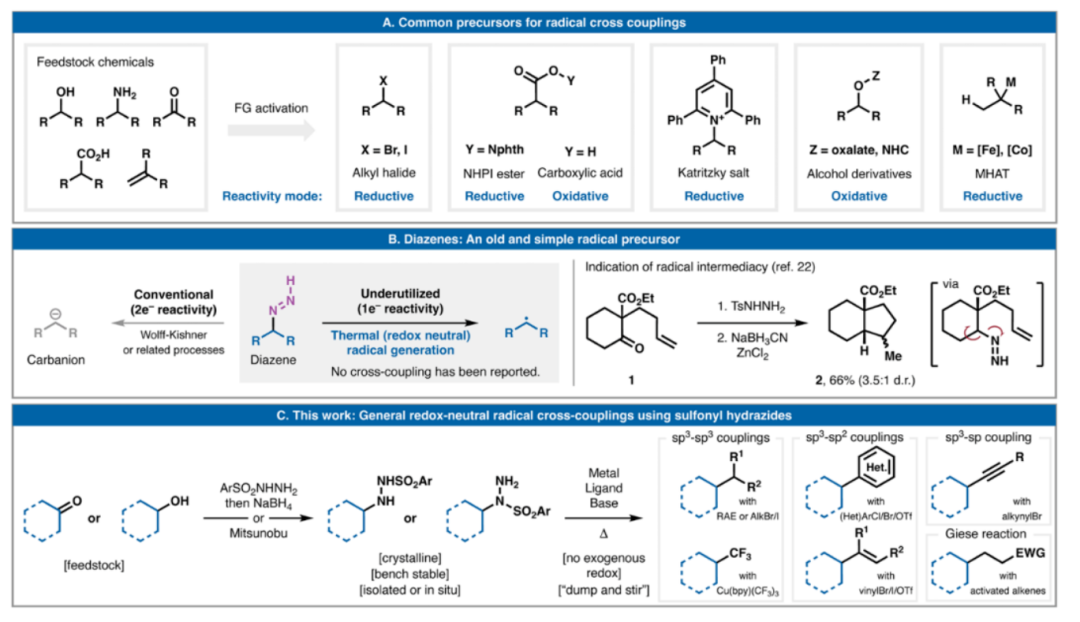
圖1. 背景和反應進展。
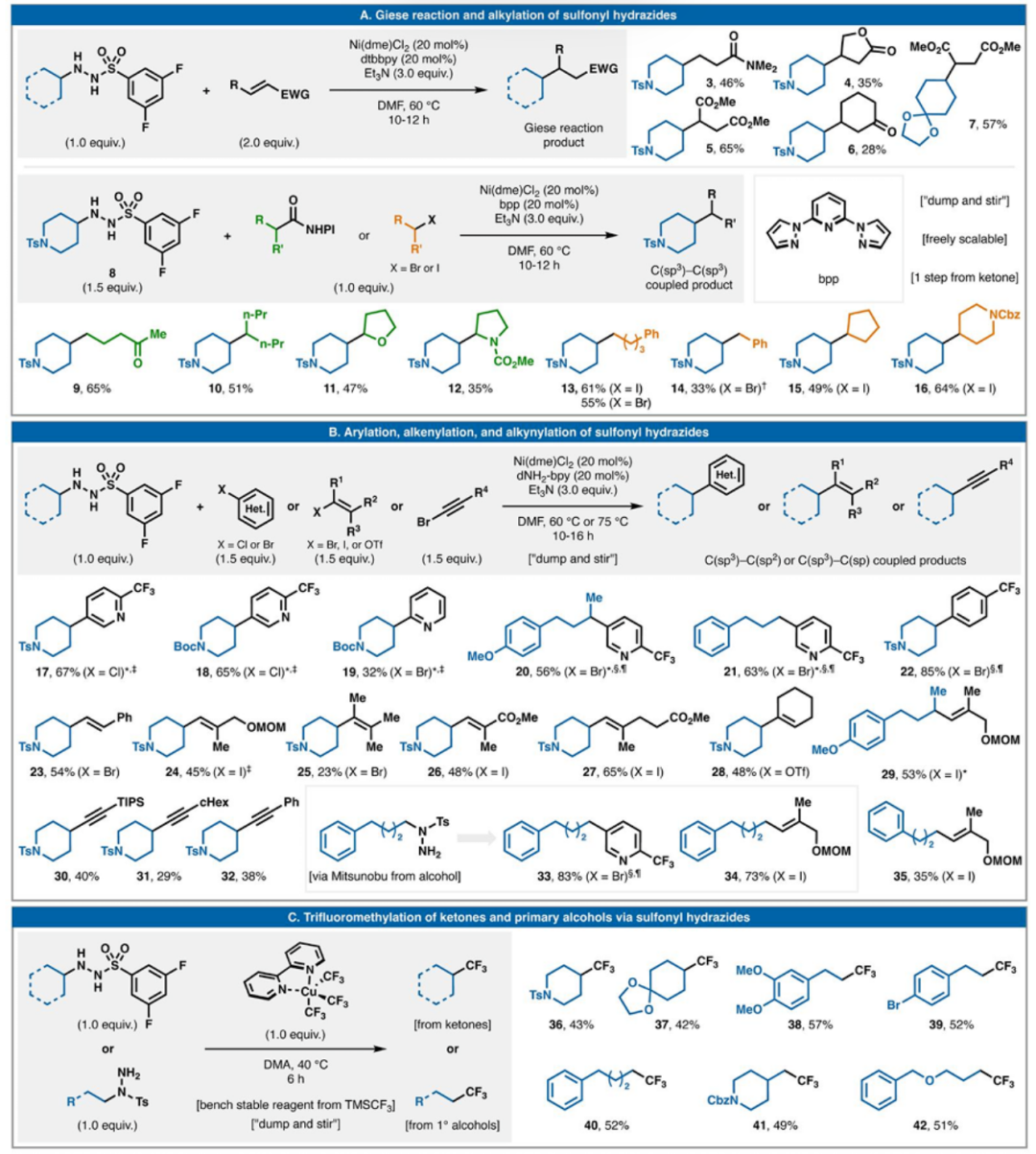
圖2. 七類與磺酰肼的氧化還原中性反應。
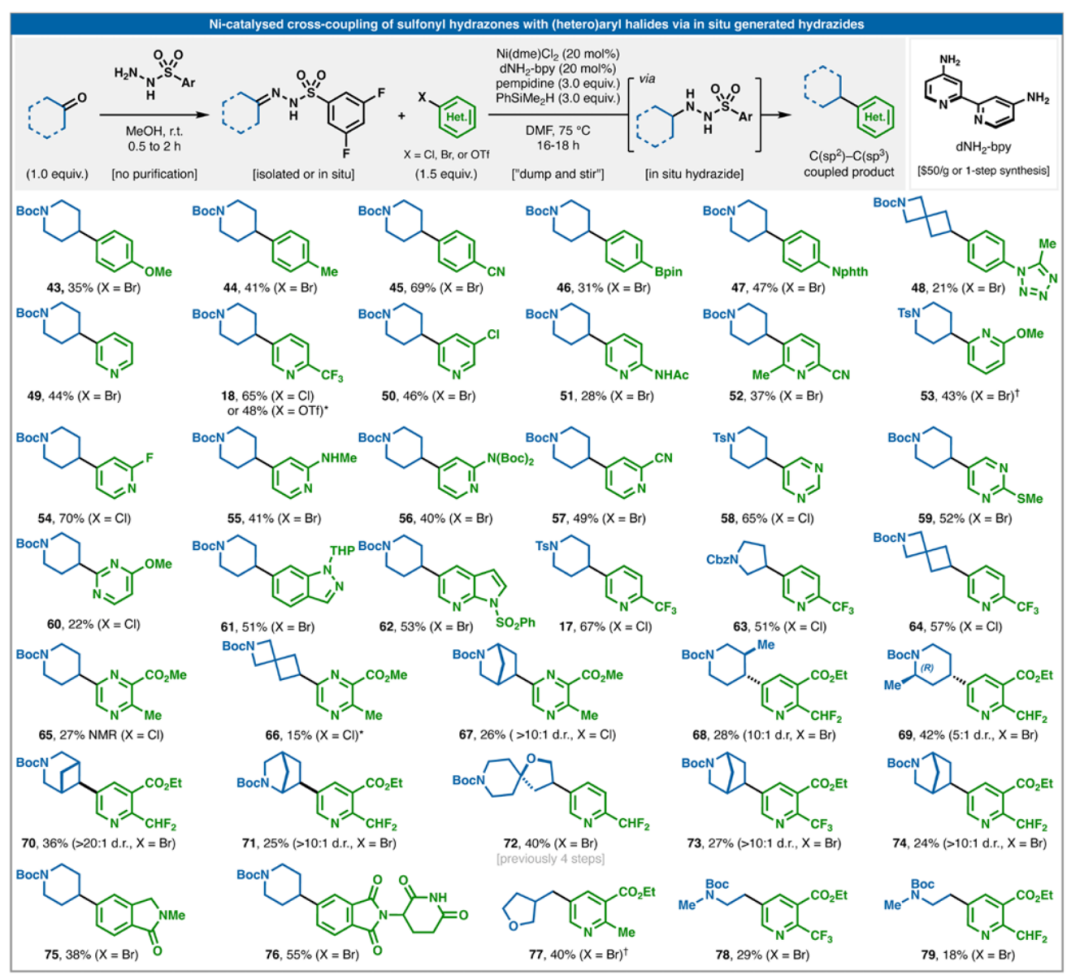
圖3.磺酰肼與芳基鹵化物偶聯的一鍋法。
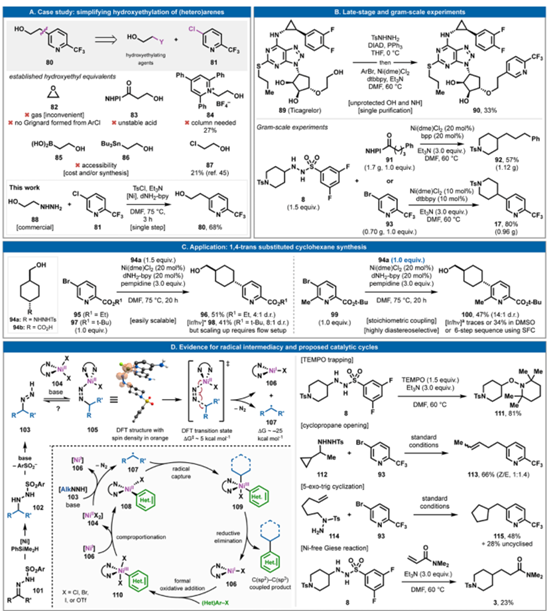
圖4. 后期應用和機理考慮。
結論展望
本研究展示了一類無需外部還原劑的磺酰肼自由基前體,在鎳催化作用下可高效構建多種碳-碳鍵。這一方法突破了傳統碳-碳偶聯反應對鈀催化和額外氧化還原試劑的依賴,拓展了鎳催化的適用范圍,體現了可持續合成化學的發展趨勢。通過氧化還原中性交叉偶聯,研究團隊成功實現了 C(sp3)-C(sp3)、C(sp3)-C(sp2) 和 C(sp3)-C(sp) 鍵的高效構建,適用于烷基、烯基、炔基及芳基等多種底物,極大地豐富了有機合成工具箱。此外,該方法采用均相水相條件,具有良好的操作簡便性和環境友好性,為溫和、高效的末端官能化提供了新策略。這一研究不僅加深了人們對自由基化學和鎳催化的理解,也為藥物合成和材料科學提供了新的思路,推動了可持續有機合成的發展。
原文詳情:
Jiawei Sun et al. ,Sulfonyl hydrazides as a general redox-neutral platform for radical cross-coupling.Science387,1377-1383(2025).DOI:10.1126/science.adu6406












