研究背景
手性大環在藥物化學和材料科學中扮演著至關重要的角色,但它們的催化不對稱合成仍然具有挑戰性。現有的方法主要依賴于線性前體的分子內環化反應和外消旋大環的非對稱分解,這通常需要復雜的合成工藝,且結構多樣性有限。
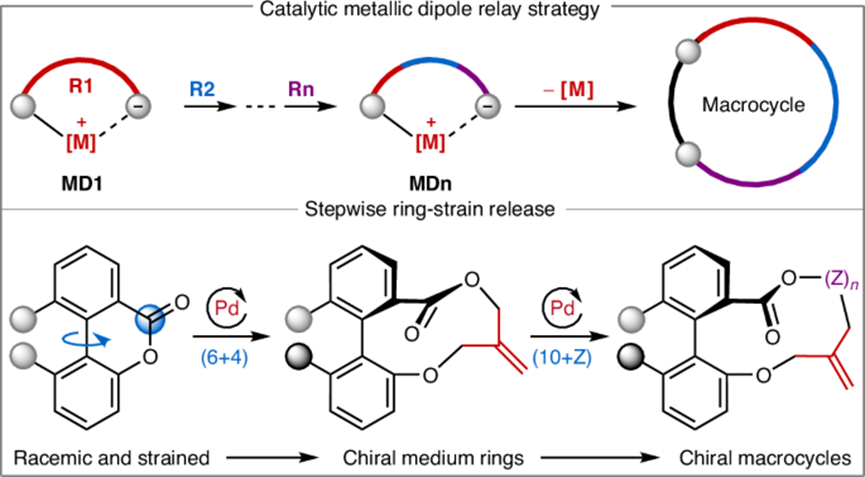
為此,華中師范大學化學學院陸良秋、肖文精、張之涵等人在“Nature Catalysis”期刊上發表了題為“Enantioselective macrocyclization via catalytic metallic dipole relay”的最新論文。本文受非核糖體環肽生物合成的啟發,提出了一種催化金屬偶極中繼策略,用于構建軸手性大乳酯。該方法通過雙芳基乳酯的逐步應力釋放和π-烯丙基-鈀偶極介導的動態動力學分解,實現了簡潔的不對稱合成。
該方法在溫和條件下對中環(最高91%產率,93%對映體過量)和大環(最高93%產率,99%對映體過量,19:1以上的對映體比)均具有廣泛的適用性。通過在中環形成和隨后的大環化過程中建立立體化學控制,這一策略克服了傳統的軸手性生成局限性,同時擴展了過渡金屬催化的不對稱環化方法。
研究亮點
(1)實驗首次提出了一種催化金屬偶極中繼策略,用于軸手性大乳酯的對映選擇性合成。該方法通過雙芳基乳酯的逐步應力釋放和π-烯丙基-鈀偶極介導的動態動力學分解,實現了簡潔的手性大環合成,突破了傳統合成方法的局限性。
(2)實驗通過采用金屬催化的偶極中繼反應,成功地在溫和條件下合成了中環(最高91%產率,93%對映體過量)和大環(最高93%產率,99%對映體過量,19:1以上的對映體比)軸手性大乳酯。該方法在合成過程中建立了立體化學控制,并在中環和大環形成過程中實現了高對映選擇性。
(3)研究還展示了該策略的廣泛適用性,適用于不同大小的環系統,具有較高的產率和優異的對映選擇性,提供了一種高效的手性大環構建方法。
(4)此外,DFT計算研究和一系列對照實驗表明,該金屬偶極中繼過程能夠有效避免不利的聚合反應,并提供了進一步優化反應條件和提高產率的理論依據。
圖文解讀
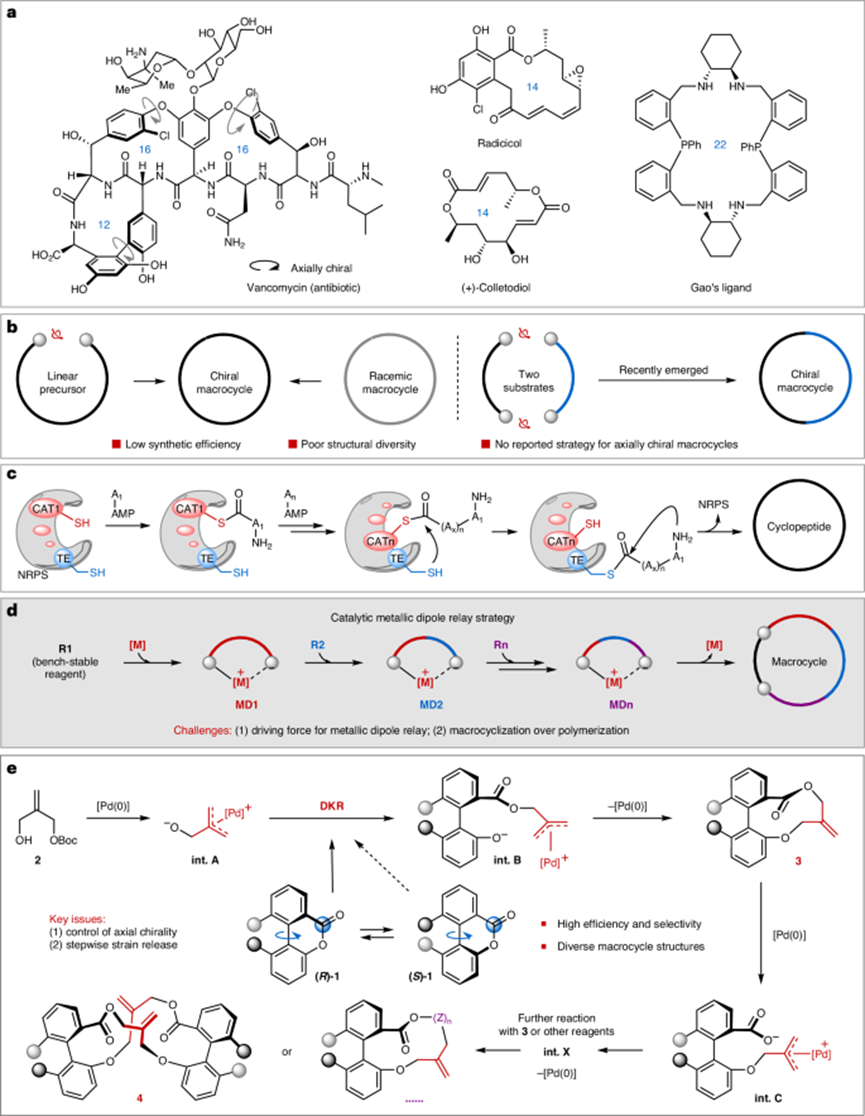
圖1:手性大環的合成計劃。
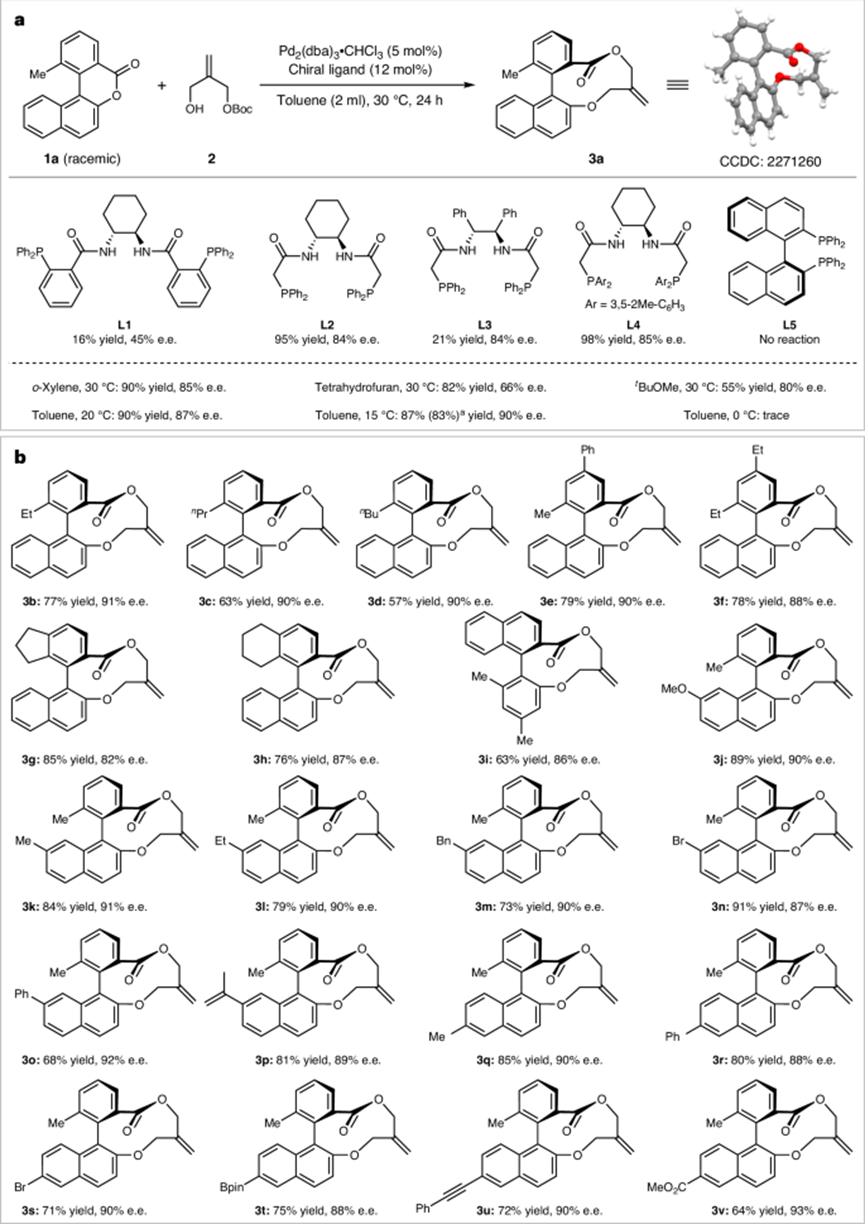
圖2:鈀催化的非對稱(6+4)環化反應結果。
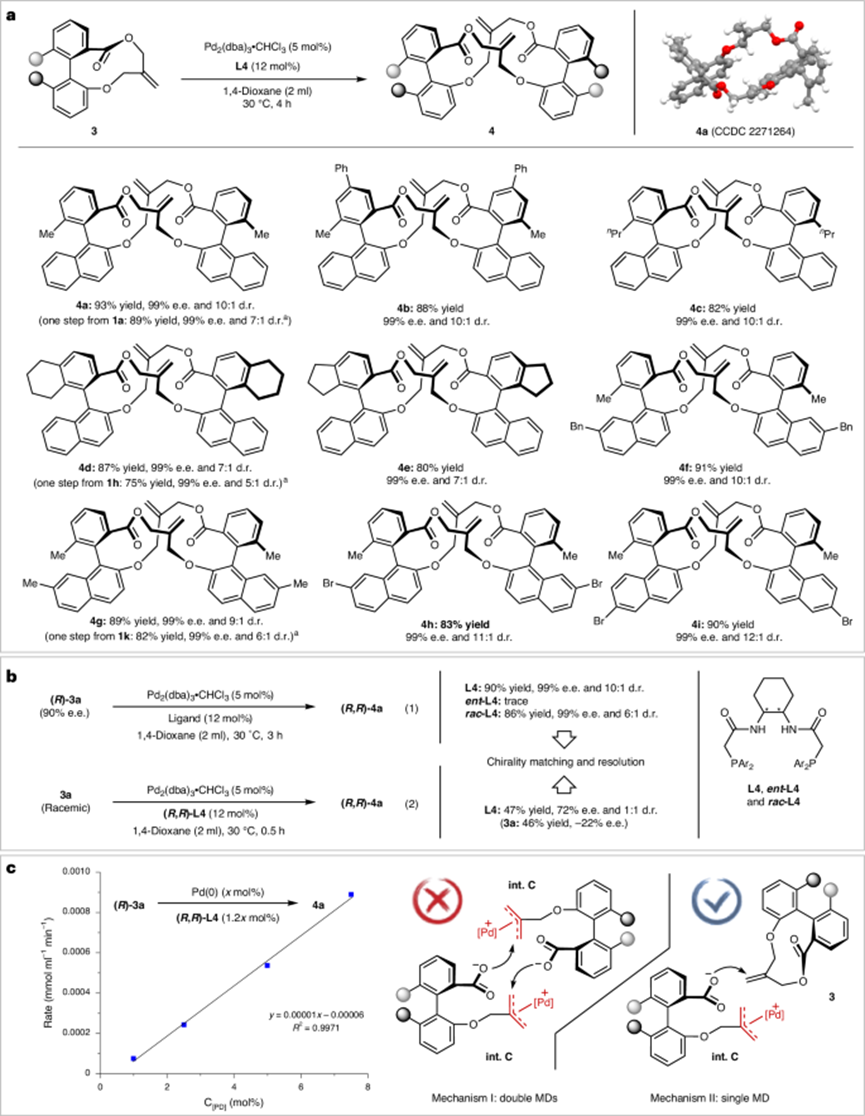
圖3:代表性手性20元大環及其機理研究。
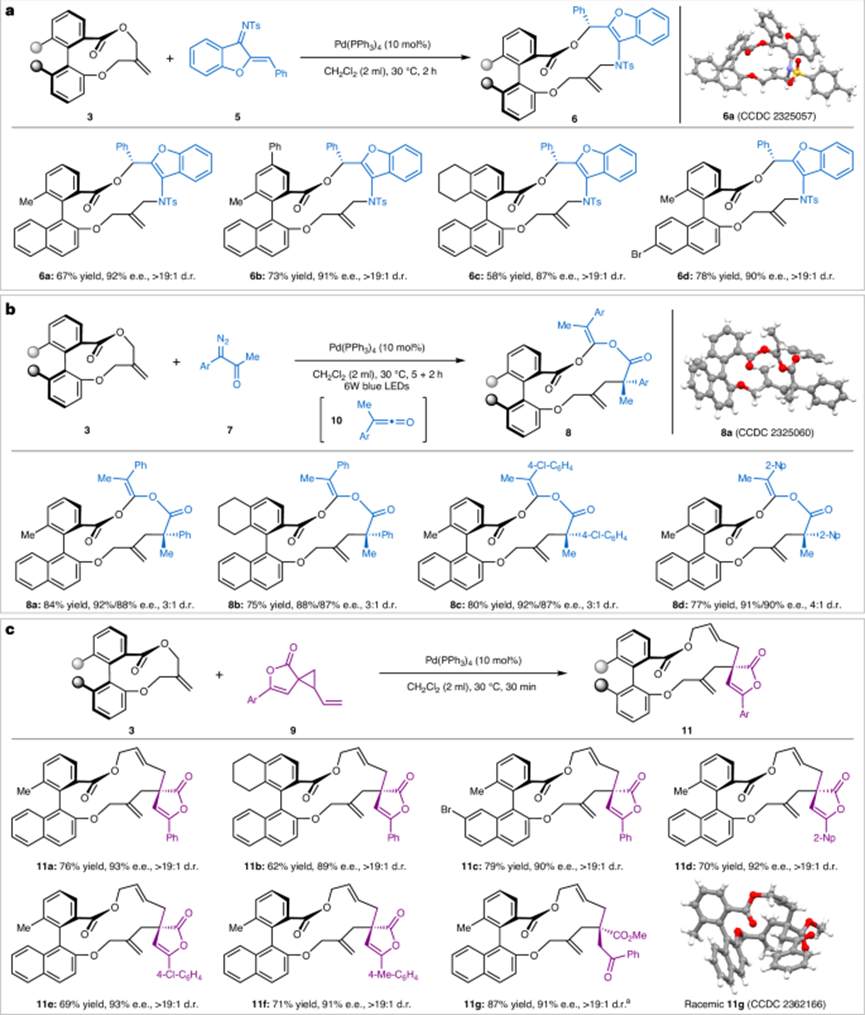
圖4:其他手性大環的代表性結果。
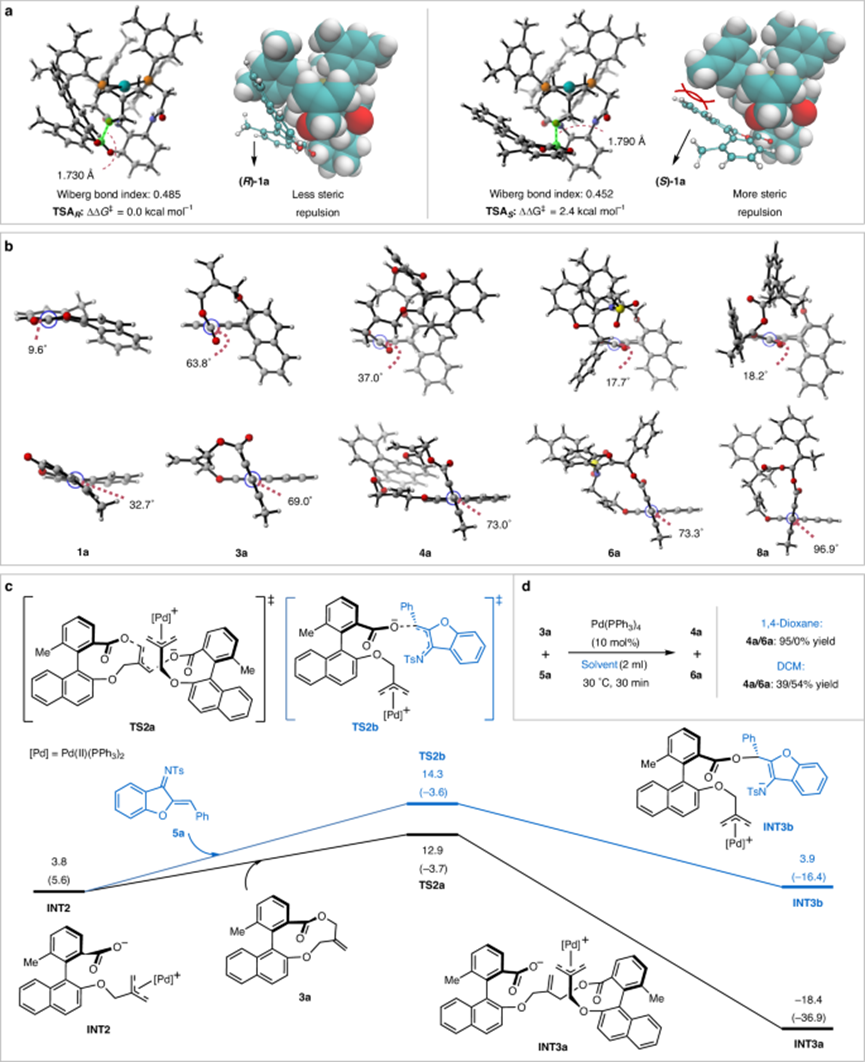
圖5:DFT計算研究和對照實驗。
總結展望
總之,本文成功開發了一種催化金屬偶極中繼策略,用于仿生對映選擇性大環化反應。該策略利用一系列原位生成的π-烯丙基-鈀偶極作為手柄,以高效率和選擇性合成結構多樣的軸手性14、15和20元大環產品。通過實驗觀察和DFT計算,發現軸向扭曲的雙芳基乳酯的逐步應力釋放是促進金屬偶極中繼反應的關鍵驅動力。可逆雙芳基乳酯的動態動力學分解使得軸手性中環的高對映選擇性合成成為可能,為后續大環化反應奠定了基礎。我們相信,這項研究提供了一種獨特的仿生策略,通過中繼不對稱鈀催化方法合成軸手性大環。
原文詳情:
Qu, BL., Xiao, M., He, L. et al. Enantioselective macrocyclization via catalytic metallic dipole relay. Nat Catal (2025).
https://doi.org/10.1038/s41929-025-01322-9












