研究背景
先前研究發現通過可切換的骨架編輯快速多樣化復雜分子中的核心環結構在藥物發現過程中具有重要價值。
然而,盡管化學分岔修飾能最大化結構多樣性和復雜性,利用常見底物對氮雜芳烴框架進行可控改性的方法仍然具有挑戰性。
在此,上海交通大學吳華課題組在“Nature Chemistry”期刊上發表了題為“Switchable skeletal editing of quinolines enabled by cyclizative sequential rearrangements”的最新論文。該團隊報道了通過布朗斯特酸催化的喹啉的可調骨架編輯,采用喹啉N-氧化物、二烷基乙炔二羧酸酯和水的多組分反應,生成含氮的雜芳香化合物和線性化合物,且反應過程模塊化。
具體而言,在一鍋法中,經過環化和序列重排過程后,喹啉N-氧化物輕松轉化為獨特的2-取代吲哚烯胺。這些隨后經歷酸促進的裂解生成吲哚、堿促進的開環反應生成2-烯基苯胺,并通過氧化環化反應生成異喹啉酮。研究者還實現了喹啉的催化不對稱骨架編輯,提供了富含對映體的苯并氮雜并烯胺,且展示了喹啉核心在多種藥物中的晚期骨架改性。
研究亮點
(1)實驗首次實現了喹啉的骨架編輯,通過布朗斯特酸催化的多組分反應,成功生成了多種含氮雜芳香化合物和線性化合物。具體而言,喹啉N-氧化物、二烷基乙炔二羧酸酯和水在一鍋法反應中經過環化和序列重排反應,輕松轉化為獨特的2-取代吲哚烯胺。
(2)實驗通過酸促進的裂解、堿促進的開環反應和氧化環化反應,實現了喹啉N-氧化物的多樣化轉化,分別生成了吲哚、2-烯基苯胺和異喹啉酮。此外,實驗還成功實現了喹啉的催化不對稱骨架編輯,提供了富含對映體的苯并氮雜并烯胺。該方法不僅能高效地多樣化骨架結構,還能夠在藥物發現和有機合成中提供有用的構建模塊。
(3)實驗還展示了該骨架編輯策略的放大反應、產物的合成轉化以及反應路徑的詳細研究,并通過對照實驗驗證了反應的可控性和高效性。實驗結果表明,這種方法具有廣泛的應用前景,尤其是在藥物核心骨架的修飾和結構優化方面。
圖文解讀
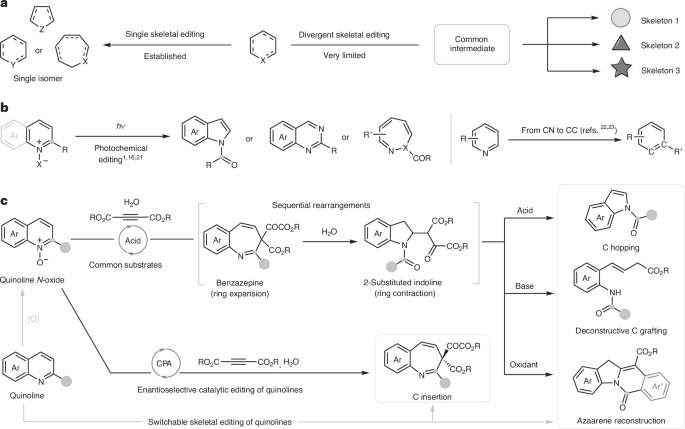
圖1:雜環的骨架編輯。
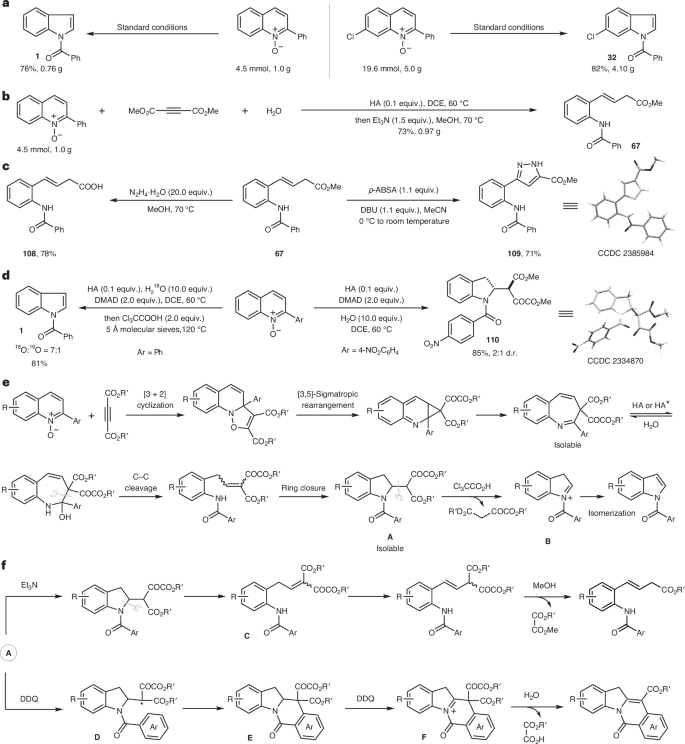
圖2:反應放大、產物的合成轉化、對照實驗和反應路徑。
結論展望
總之,本文開發了一種環化序列重排策略,用于喹啉的化學分岔骨架編輯。在這種方法中,通過單碳躍遷、解構性碳嫁接和氮雜芳烴重建,能夠在一鍋法中高效地構建多種結構多樣的吲哚、2-烯基苯胺和聯苯并異喹啉酮。此外,基于手性磷酸催化,研究者還實現了通過碳原子插入的催化不對稱骨架編輯。
該反應具有良好的可擴展性和強大的反應性,在易得的起始材料和廉價催化劑的存在下進行,對空氣和濕氣不敏感,且具有廣泛的底物適應性和足夠的復雜性。通過成功的藥物改性晚期應用,研究者還展示了該策略的實用性。這些分子間多組分環化重排反應實現了芳香雜環的可調和不對稱編輯,預計將在這一前沿領域引起更多關注。
原文詳情:
Tian, D., He, YP., Yang, LS. et al. Switchable skeletal editing of quinolines enabled by cyclizative sequential rearrangements. Nat. Chem. (2025).
https://doi.org/10.1038/s41557-025-01793-0












