1.Nat. Commun.:靶向BRD4/FOXO3a/CDK6來增強AKT在乳腺癌中的抑制作用
BRD4控制著對癌癥發展至關重要的基因的表達。然而,目前對于BRD4介導的基因轉錄是否需要腫瘤細胞去產生耐藥性這一問題還不清楚。Liu等人的數據顯示,長期使用AKT抑制劑治療乳腺癌細胞會誘導FOXO3a去磷酸化、核易位,并破壞其與SirT6的結合,最終導致FOXO3a乙酰化和BRD4的識別。乙酰化的FOXO3a會識別BRD4的BD2結構域,將BRD4/RNAPII復合物募集到CDK6基因啟動子上并誘導其轉錄。通過藥物抑制BRD4/FOXO3a的聯合或CDK6都能顯著克服乳腺癌細胞對AKT抑制劑的體內外抗性。這一研究也為BRD4/FOXO3a/CDK6參與治療耐藥乳腺癌提供了新的方法。
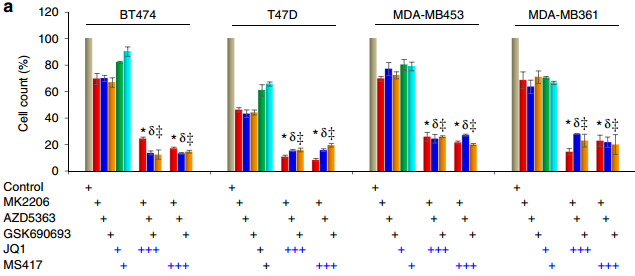
Liu J Y, Duan Z B, et al. Targeting theBRD4/FOXO3a/CDK6 axis sensitizes AKT inhibition in luminal breast cancer[J]. Nature Communications, 2018.
DOI: 10.1038/s41467-018-07258-y
https://www.nature.com/articles/s41467-018-07258-y
2.楊陽&游經碧Nat. Commun.評論:大牛發聲!呼吁鈣鈦礦器件的穩定性標準化!
將光伏技術從實驗室轉化為商業產品時,低成本,高功率轉換效率,高穩定性(長壽命)是必須考慮的三個關鍵指標。作為最有前景的高效光伏材料,有機-無機金屬鹵化物鈣鈦礦(PSCs)引起了基礎研究的極大關注,但因其穩定性測試條件五花八門,所以很難理性地評判其商業化價值。近日,楊陽聯合游經碧課題組討論了鈣鈦礦的穩定性問題,并且呼吁PSCs穩定性測試的標準化協議盡可能與硅太陽能電池工業標準匹配。
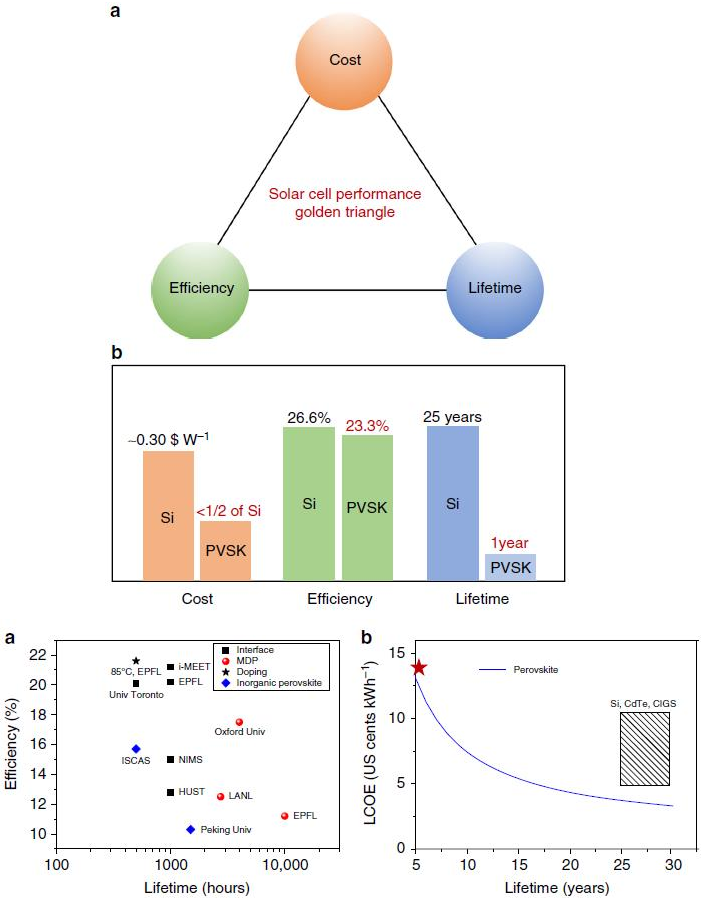
Meng L, You J & YangY. Addressing the stability issue of perovskite solar cells for commercial applications[J]. Nature Communications, 2018.
DOI: 10.1038/s41467-018-07255-1.
https://doi.org/10.1038/s41467-018-07255-1
3.李永舫&閔杰EES:逐層溶液法制備高效非富勒烯有機太陽能電池
逐層(LbL)溶液法是用于大規模制造有機太陽能電池(OSC)的成本有效的技術。武漢大學高等研究院閔杰聯合李永舫院士團隊等使用PTQ10 /J71作為供體,ITC6-IC / IDIC / MeIC / ITCPTC / ITIC分別作為非富勒烯受體(NFA)。與傳統的本體異質結(BHJ)OSC相比,相應的溶液處理LbL器件表現出更高效率。進一步,采用刮刀工藝制造大面積LbL OSC。基于J71 / ITC6-IC和PTQ10 / IDIC LbL (有效面積為1.00 cm2) 的兩個器件效率均超過10%,這是迄今為止文獻中報道的大面積LbL OSC的紀錄效率。
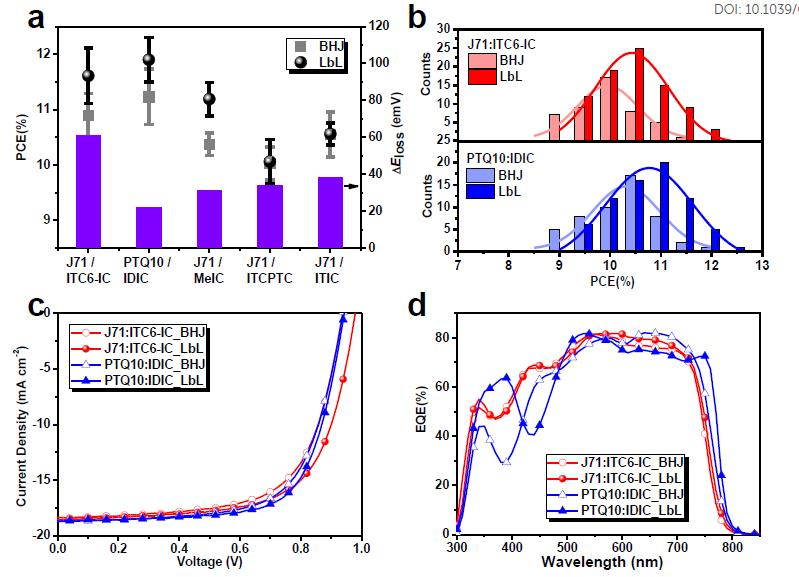
Min J, et al. A Universal Layer-by-Layer Solution-Processing Approach for Efficient Non-fullerene Organic Solar Cells[J].Energy & Environmental Science, 2019.
DOI: 10.1039/C8EE02560F
http://dx.doi.org/10.1039/C8EE02560F
4.Omar M. Yaghi最新JACS:用于選擇性甲烷氧化成甲醇的仿生MOF催化劑
微粒狀甲烷單加氧酶(pMMO)是一種將甲烷氧化成甲醇的酶,具有高活性和選擇性。在合成系統中摻入生物相關配體以形成該活性位點是一種有效策略。Omar M. Yaghi課題組報告了由pMMO啟發的金屬有機骨架(MOF)催化劑的設計和合成,用于選擇性甲烷氧化成甲醇。通過優化具有適當拓撲結構和化學功能的框架,MOF-808用于合成后安裝帶有咪唑單元的配體,用于隨后在分子氧存在下用Cu(I)金屬化。該催化劑在150 ℃的等溫條件下對甲烷氧化成甲醇具有高選擇性。研究表明,雙(μ-oxo)雙銅物種可能是催化劑的活性位點。
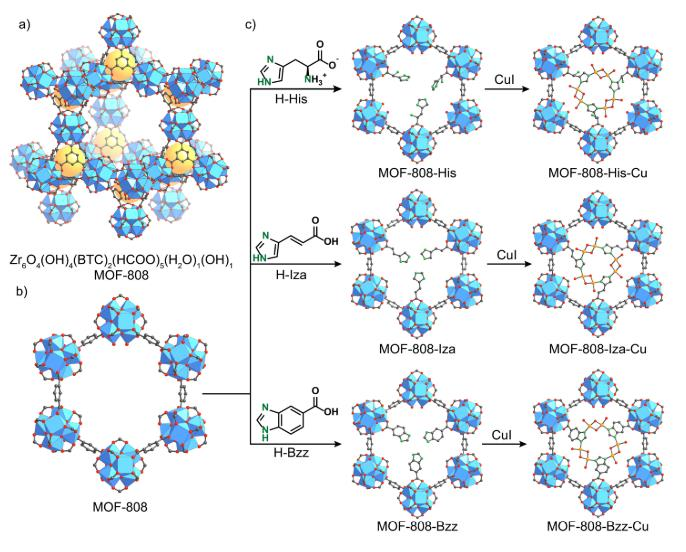
Baek J, et al.Bioinspired Metal-Organic Framework Catalysts for Selective Methane Oxidationto Methanol[J]. Journal of the American Chemical Society, 2018.
DOI: 10.1021/jacs.8b11525
https://doi.org/10.1021/jacs.8b11525
5.ACS Catal.:周圍條件下Fe-N/C復合材料用于NRR
發展高效、無貴金屬、在周圍條件下電催化氮氣還原反應(NRR)的催化劑對化肥生產,儲氫的工業化具有重要的意義。作者設計并制備了無貴金屬的Fe-N/C-CNTs復合材料用于電催化NRR。實驗表明,該催化劑在周圍條件下,水媒介中能顯著提高N2電催化還原成NH3的活性。進一步實驗研究和理論計算表明,該材料中Fe-N3結構是NRR主要的活性中心。
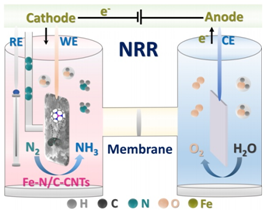
Wang Y, Cui X, Zheng W, et al. Rational Design of Fe-N/C Hybrid for Enhanced Nitrogen Reduction Electrocatalysis under Ambient Conditions in Aqueous Solution[J]. ACS Catalysis, 2018.
DOI:10.1021/acscatal.8b03802
https://pubs.acs.org/doi/10.1021/acscatal.8b03802
6.ACS Nano:CuO@ZrO2納米復合材料緩解腫瘤缺氧增強化學微波熱療腫瘤
癌細胞的易轉移性和乏氧的特點都會對癌癥治療造成阻礙。Chen等人以微波(MW)激發CuO的氧釋放能力為基礎設計了一種多功能核殼CuO@ZrO2納米復合材料用于改善乏氧的化學-微波治療腫瘤。實驗將1-丁基-3-甲基咪唑六氟磷酸鹽(IL)負載到CuO@ZrO2納米復合材料中用于改進微波熱療(MWTT),并加入1-十四醇(1-Tetradecanol, PCM)來調節阿霉素(DOX)化療藥物的釋放,得到IL-DOX-PCM-CuO@ZrO2多功能(IDPC@Zr)納米復合材料,最后采用mPEG-SH對IDPC@Zr納米復合材料進行改性。結果發現在腫瘤治療過程中,IDPC@ZrPEG納米復合材料可以在腫瘤微環境中產生氧氣,從而緩解腫瘤的缺氧狀態,提高治療效果。體內抗腫瘤實驗證明,其腫瘤抑制率可達到92.14%。此外,由于Zr的原子序數較高,它可以增強CT成像對比度。因此,IDPC@Zr-PEG納米復合材料可以用于腫瘤治療過程的實時監測。
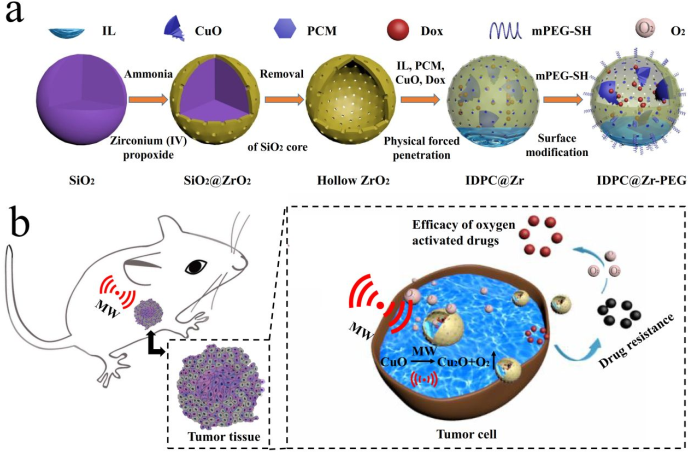
Chen Z Z, Niu M, et al. Oxygen Production of Modified Core-Shell CuO@ZrO2 Nanocomposites by Microwave Radiation to Alleviate Cancer Hypoxia for Enhanced Chemo-Microwave Thermal Therapy[J]. ACS Nano, 2018.
DOI: 10.1021/acsnano.8b07749
https://pubs.acs.org/doi/10.1021/acsnano.8b07749
7.堪薩斯州立大學AFM:仿生天然殺傷膜偽裝聚合物納米顆粒用于靶向生物成像
Pitchaimani等人利用腫瘤導引的天然殺傷性細胞膜(NKM)、近紅外(NIR)熒光染料和釓(Gd)共軛核磁共振造影劑,在聚合物納米顆粒表面構建了具有多模態成像系統的仿生納米結構(BNc)。實驗通過調節BNc表面Gd-脂質共軛濃度,可以在14.1 T下對BNc的磁性進行調節。共聚焦成像和細胞分選分析顯示,與裸聚合物納米顆粒相比,BNc與MCF-7細胞之間有著非常明顯的相互作用,這表明NKM的偽裝系統具有腫瘤靶向的特性。而藥代動力學和生物分布分析則顯示,BNc在MCF-7誘導的荷瘤裸鼠體內半衰期更長(9.5 h),腫瘤積累量也更高。由于目前NK細胞用于免疫治療潛力已得到證實,這種BNc也有望成為納米醫學選擇之一。

Pitchaimani A, Nguyen T D T, et al.Biomimetic Natural Killer Membrane Camouflaged Polymeric Nanoparticle for Targeted Bioimaging[J]. Advanced Functional Materials, 2018.
DOI: 10.1002/adfm.201806817
https://doi.org/10.1002/adfm.201806817
8.弗吉尼亞理工學院Adv. Sci.:納米級細菌自主給藥系統增強納米藥物的瘤內轉運
由于納米藥物的全身毒性和其對血管遠端細胞的運輸不足等缺點的存在,腫瘤藥物的有效遞送仍然是一個不小的難題。Suh等人開發了一種納米級的細菌自主給藥系統(NanoBEADS),該系統是將腫瘤靶向菌VNP20009與聚乳酸-乙醇酸納米顆粒結合在一起所構建的。實驗研究了NanoBEADS對癌細胞的侵襲、其在腫瘤內的輸運和其在乳腺腫瘤模型體內生物分布等,結果發現細胞間的自復制和易位是影響細菌瘤內滲透的主要機制,納米顆粒的共軛作用并不影響細菌的瘤內轉運性能。研究也表明NanoBEADS可以在不需要任何外力或控制輸入的情況下,將納米顆粒在實體腫瘤中的保留和分布提高100倍。這一研究也為改善癌癥藥物治療提供了一個新的思路。
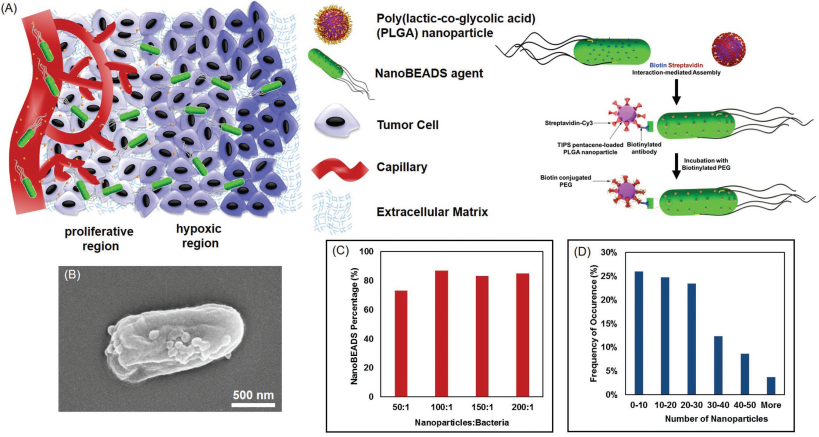
Suh S, Jo A, et al. Nanoscale Bacteria-Enabled Autonomous Drug Delivery System (Nano BEADS) EnhancesIntratumoral Transport of Nanomedicine[J]. Advanced Science, 2018.
DOI: 10.1002/advs.201801309
https://doi.org/10.1002/advs.201801309











