
作為一種功能性生物大分子,DNA已被廣泛用于分析化學(xué)、醫(yī)學(xué)診斷和疾病治療。由于DNA難以穿過(guò)細(xì)胞膜且易被降解,如何實(shí)現(xiàn)DNA有效遞送成為該領(lǐng)域發(fā)展的關(guān)鍵。目前,研究人員開(kāi)發(fā)了各種類(lèi)型的納米載體(例如:高分子膠束、脂質(zhì)體、無(wú)機(jī)納米粒子),以實(shí)現(xiàn)體外和體內(nèi)核酸遞送,但面臨著制備困難、效率低和安全性差的問(wèn)題。
近年來(lái),DNA納米技術(shù)得到了迅猛發(fā)展,并在核酸及小分子藥物遞送方面展現(xiàn)出巨大的潛力。DNA自組裝納米結(jié)構(gòu)主要包括:Ned Seeman團(tuán)隊(duì)發(fā)展的瓦塊 (tile) 自組裝,Paul Rothemund博士發(fā)明的DNA折紙術(shù)(DNA origami),以及Chad Mirkin課題組發(fā)展的球形核酸 (spherical nucleic acids)。然而,這些方法往往需要使用大量預(yù)先設(shè)計(jì)的不同序列的核酸鏈進(jìn)行組裝或者對(duì)核酸特定位點(diǎn)進(jìn)行修飾及表面功能化,如此復(fù)雜的合成方法阻礙了其在生物醫(yī)學(xué)領(lǐng)域的廣泛應(yīng)用。因此,發(fā)展簡(jiǎn)單、高效的組裝方法以構(gòu)建多功能DNA納米結(jié)構(gòu)仍然是DNA納米技術(shù)領(lǐng)域的一大難題。
有鑒于此,李樂(lè)樂(lè)課題組受傳統(tǒng)金屬-有機(jī)配位化學(xué)的啟發(fā),首次提出利用金屬配位驅(qū)動(dòng)自組裝構(gòu)建DNA納米結(jié)構(gòu)的新概念,發(fā)明了一種自組裝合成DNA納米結(jié)構(gòu)的新方法學(xué),構(gòu)建了一類(lèi)新型DNA納米材料——金屬-DNA納米結(jié)構(gòu),并表明該體系可用于細(xì)胞及活體水平高效核酸遞送。
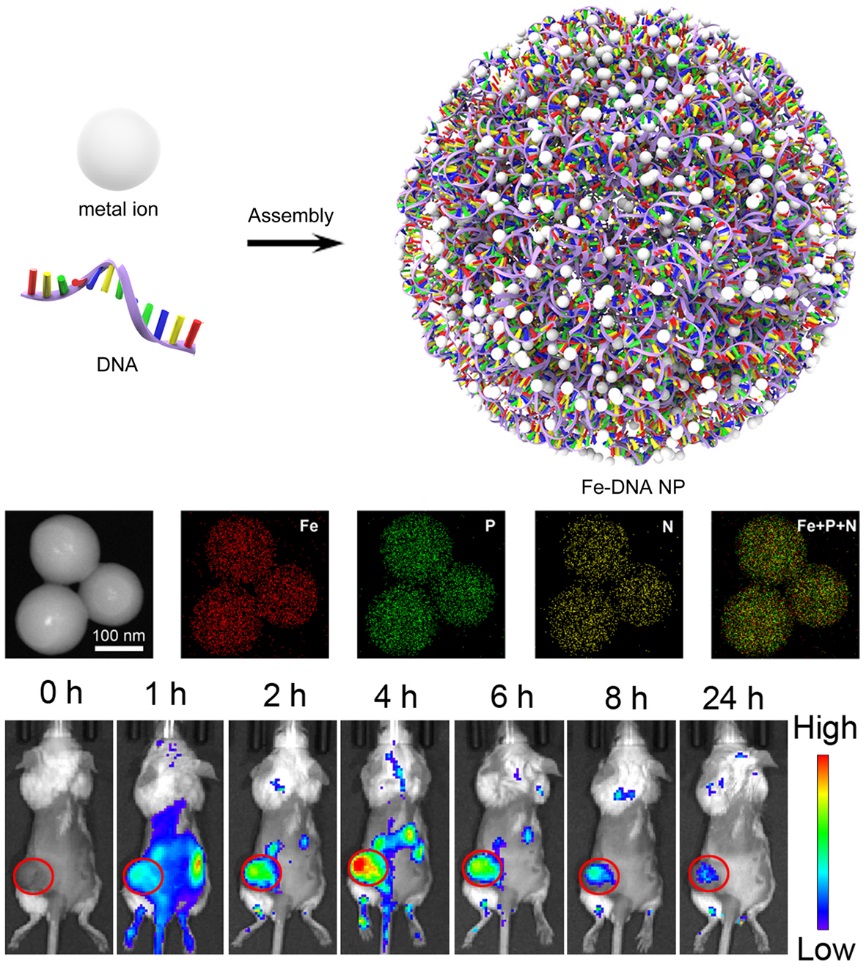
該方法非常簡(jiǎn)單,只需要將DNA分子和金屬離子(亞鐵離子)在一定的溫度下于水中混合,即可快速、高產(chǎn)率地獲得具有球形形貌的金屬-DNA納米結(jié)構(gòu)。而且,通過(guò)調(diào)節(jié)DNA分子和金屬離子的比例及濃度,可以精準(zhǔn)調(diào)控金屬-DNA納米結(jié)構(gòu)的尺寸和組分。研究人員已將該金屬-DNA納米結(jié)構(gòu)成功應(yīng)用于核酸藥物遞送。研究表明,作為新穎的、無(wú)載體的核酸遞送系統(tǒng),金屬-DNA納米結(jié)構(gòu)可將核酸藥物有效地遞送到不同的細(xì)胞中,并且在體外和體內(nèi)均發(fā)揮高效的生物識(shí)別和藥效作用。
該工作展示了金屬配位驅(qū)動(dòng)的自組裝在合成DNA納米材料方面的潛力,為DNA納米結(jié)構(gòu)的構(gòu)建開(kāi)辟了新的方法學(xué)。相比于快速興起和發(fā)展的金屬-有機(jī)框架材料(MOFs),研究人員相信該類(lèi)金屬-DNA納米材料將會(huì)極大地推進(jìn)DNA納米生物技術(shù)和金屬配位化學(xué)領(lǐng)域的發(fā)展。此外,該方法將有助于設(shè)計(jì)多功能生物材料,應(yīng)用于生物傳感、生物成像和藥物/基因遞送。
參考文獻(xiàn):
Lele Li et al. Engineering Multifunctional DNA Hybrid Nanospheres through Coordination‐Driven Self‐Assembly. Angew 2018.
https://onlinelibrary.wiley.com/doi/10.1002/anie.201810735











