1. EPFL最新Angew.:非鉛無空穴傳輸層的鈣鈦礦太陽能電池
Zimmermann等人報道了一種低維錫基鈣鈦礦的合成和表征。研究發現,采用對稱的咪唑鎓陽離子如苯并咪唑鎓(Bn)和苯并二咪唑鎓(Bdi)可以形成具有相對窄的帶隙的二維鈣鈦礦,Bn2SnI4和BdiSnI4的光學帶隙值分別為1.81 eV,1.79 eV。而且,研究證明了這類鈣鈦礦的光學性質可以形成準2D鈣鈦礦Bn2 FASn2I7。另外,也可以制備Bn2SnxPbx-1I4。基于Bn2SnI4的器件效率約為2.3%。
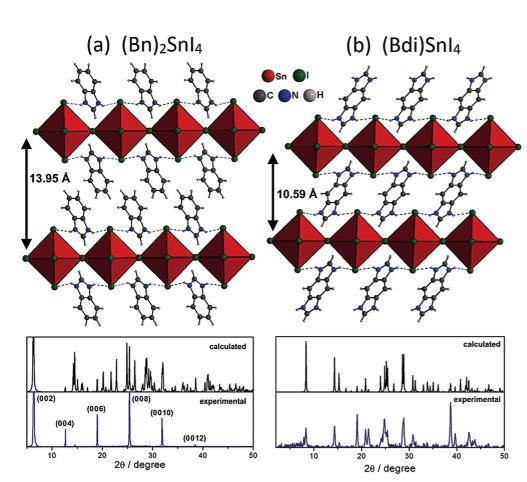
Zimmermann I, Aghazada S & Nazeeruddin M K. Lead and HTM Free Stable Two-Dimensional Tin Perovskites with Suitable Band Gap for Solar Cell Applications[J].Angewandte Chemie International Edition, 2018.
DOI: 10.1002/anie.201811497
https://doi.org/10.1002/anie.201811497
2. 黃云輝Angew.:基于全甲基化環醚的穩定的Li-O2電池電解質
醚類電解質憑借其高穩定性被廣泛應用于Li-O2電池中。但是,醚類電解液仍然容易受到氫抽提反應中的超氧化物和單線態氧的進攻,因此容易導致長期循環過程中的性能衰減。在本文中,華中科技大學的黃云輝教授團隊提出了一種全甲基化的環醚用于實現超穩定的Li-O2電池。這種環醚結構中不包含任何α碳原子上的氫原子,因此從根本上避免了氫抽提反應的發生,所以其能夠在超氧化物和單線態氧存在的情況下保持穩定。
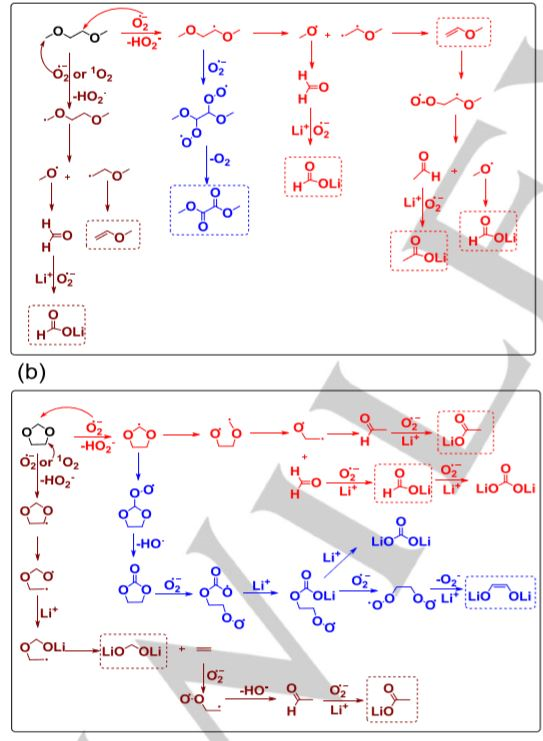
Huang Z, Zeng H, et al. A stablelithium‐oxygen battery electrolyte based on fully methylatedcyclic ether[J]. Angewandte Chemie International Edition,2018.
DOI:10.1002/ange.201812983
https://onlinelibrary.wiley.com/doi/abs/10.1002/ange.201812983?af=R
3. Angew.:Cu(100)晶面的親鋰性---鋰金屬負極載體表面和空間的高效利用
金屬鋰負極面臨著嚴重的循環穩定性問題和潛在的安全問題。為了解決這些問題,在集流體上制備薄膜金屬鋰負極和包括在集流體上直接沉積鋰在內的無鋰型負極受到了廣泛的關注。本文報道了基于Li(110)晶面與Cu(100)晶面晶格重合的親鋰性表面原子尺度設計,以及Cu(100)晶面低成核勢壘優選表面電化學結構。他們還針對集流體上制備的金屬鋰負極設計了相應的固態電解質界面。該項研究不僅成功地制備了平滑的鋰表面薄膜,而且利用三維集流體的表面和空間實現了均勻穩定的金屬鋰電化學剝離與沉積。
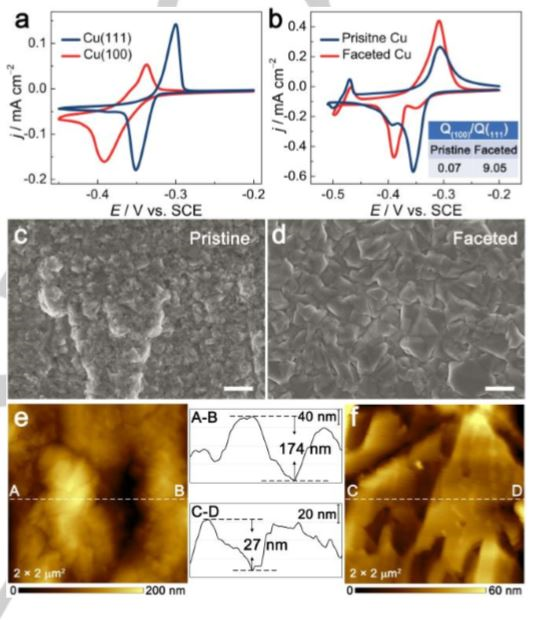
Gu Y, Xu H-Y, et al. Cu(100) Faceted Surfacefor Lithiophilicity: High‐Utilization of Surface and Space of Hosts for Lithium Metal Anodes[J]. Angewandte Chemie International Edition, 2018.
DOI: 10.1002/ange.201812523
https://onlinelibrary.wiley.com/doi/abs/10.1002/ange.201812523?af=R
4. 河北大學ACS Nano:Y2O3納米顆粒通過破壞骨髓基質細胞內磷酸鹽的平衡而引起骨組織損傷
Y2O3納米顆粒(NPs)已成為納米科學特別是生物醫學應用領域的一種極具發展前景的產品。眾所周知,這種稀土(RE)物質會沉積在骨骼中,其從體內排泄出去的過程非常緩慢。Gao等人研究了Y2O3 NPs對小鼠骨髓基質細胞(BMSCs)和骨代謝的影響。結果表明,Y2O3 NPs可進入骨髓間充質干細胞后存在細胞內溶酶體中,并由Y2O3轉化為YPO4,從而打破細胞內磷酸鹽平衡,誘導溶酶體和線粒體依賴性凋亡通路。小鼠模型上的數據則證明注射Y2O3 NPs后,小鼠骨內釔的濃度會升高,從而導致骨細胞凋亡和骨結構破壞。而通過在溶酶體模擬體液(LSBF)中預處理Y2O3 NPs,即在Y2O3 NPs表面形成YPO4包覆層后則可以明顯降低其體內外的毒性。這一研究對開發Y2O3 NPs在生物醫學領域的應用具有一定的指導意義。
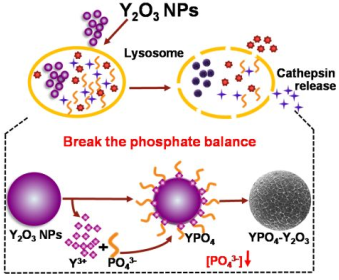
Gao C Y, Jin Y, et al. Y2O3 Nanoparticles Caused Bone Tissue Damage by Breaking the Intracellular Phosphate Balance in Bone Marrow Stromal Cells[J]. ACS Nano, 2018.
DOI: 10.1021/acsnano.8b06211
https://pubs.acs.org/doi/10.1021/acsnano.8b06211
5. AFM:核酸包覆的MOF納米顆粒用于酶驅動釋放藥物
Chen等人設計了經核酸修飾的UiO-68金屬有機骨架納米顆粒NMOFs,它可以用于負載抗癌藥物喜樹堿。NMOFs釋放藥物的過程則是由酶驅動的生物催化分解來觸發的。可使用的酶有DNase I酶、內切酶(EcoRI)和外切酶III (Exo III)等等。這種負載喜樹堿的NMOFs對MDA-MB-231癌細胞具有選擇性的細胞毒性,癌細胞凋亡率可達到55%,而上皮細胞MCF-10A僅凋亡15%。
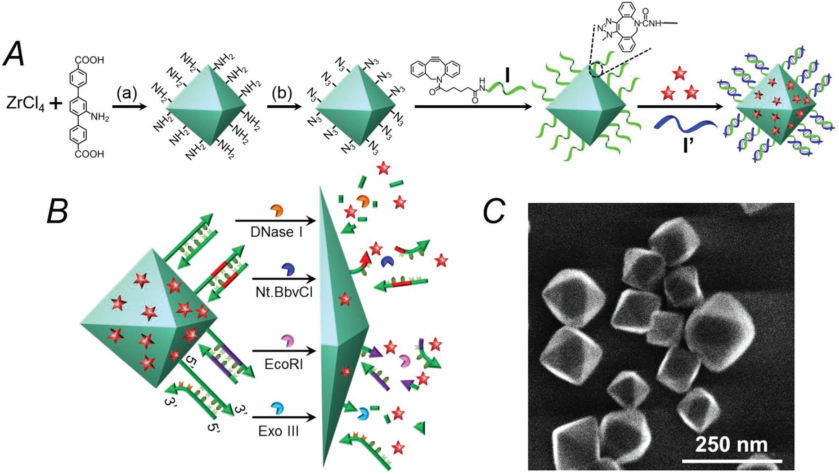
ChenW H, Luo G F, et al. Enzyme-Driven Release of Loads from Nucleic Acid-Capped Metal-Organic Framework Nanoparticles[J]. Advanced Functional Materials, 2018.
DOI:10.1002/adfm.201805341
https://doi.org/10.1002/adfm.201805341
6. Adv. Sci.:對pH/ROS響應的電荷反轉納米系統用于氧化-化療協同治療
細胞對藥物的吸收不良是抗癌治療面臨的主要挑戰之一。而無法在腫瘤部位釋放足夠的藥物和耐多藥性(MDR)也會進一步限制治療的效果。Dai等人設計了一種具有電荷反轉能力和自放大藥物釋放模式的納米遞送系統,它是一種封裝β-拉帕醌的高分子膠束。在弱酸性腫瘤微環境下,該膠束系統的表面電荷可以由負轉換為正,從而增強腫瘤細胞對它的攝取。隨后,該膠束系統可以對活性氧(ROS)豐富的胞內環境產生響應,導致其在胞質釋放β-拉帕醌和喜樹堿(CPT)。此外,釋放的β-拉帕醌能在煙酰胺腺嘌呤二核苷酸的催化下產生ROS,最終可以克服耐多藥性。體內外的研究一致表明,這種具有對pH響應的電荷逆轉、上調腫瘤ROS水平和自放大對ROS響應的藥物釋放的納米材料可以通過氧化-化療的協同治療達到強效的抗腫瘤作用。
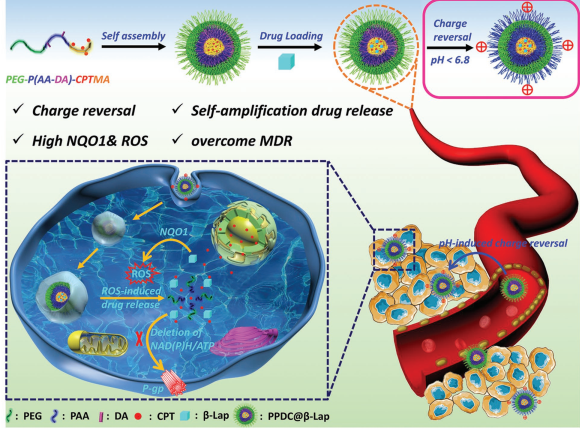
Dai L L,Li X, et al. A pH/ROS Cascade-Responsive Charge-Reversal Nanosystem withSelf-Amplifed Drug Release for Synergistic Oxidation-Chemotherapy[J]. AdvancedScience, 2018.
DOI:10.1002/advs.201801807
https://doi.org/10.1002/advs.201801807












