
第一作者:宋彥齡
通訊作者:楊朝勇
研究亮點(diǎn):
1. 提出了基于流體力學(xué)分離與仿生多價(jià)識(shí)別的多尺度協(xié)同循環(huán)腫瘤細(xì)胞捕獲富集新策略。
2. 通過(guò)加入谷胱甘肽進(jìn)行配體交換,實(shí)現(xiàn)循環(huán)腫瘤細(xì)胞無(wú)損釋放進(jìn)行下游細(xì)胞培養(yǎng)及基因突變檢測(cè)。

為什么要發(fā)展基于循環(huán)腫瘤細(xì)胞的液體活檢方法
眾所周知,癌癥的早期篩查、早期診斷和預(yù)后監(jiān)測(cè)是提高患者生活質(zhì)量及生存率的重要保障。作為腫瘤診斷的金標(biāo)準(zhǔn),組織活檢存在取樣困難、侵入性大、代表性不全、存在并發(fā)癥風(fēng)險(xiǎn)等不足,因此亟需發(fā)展新型腫瘤精準(zhǔn)診斷新方法。
近年來(lái),針對(duì)血液等體液中循環(huán)靶標(biāo)包括循環(huán)腫瘤細(xì)胞(CTC)的液體活檢被認(rèn)為是今后癌癥體外檢測(cè)的發(fā)展方向之一,已成為當(dāng)前惡性腫瘤診斷領(lǐng)域的前沿。
CTC是存在于外周血中各類腫瘤細(xì)胞的統(tǒng)稱,從腫瘤母體脫離、浸潤(rùn)周圍組織而進(jìn)入血液中,通過(guò)血液循環(huán)抵達(dá)其他器官和組織,導(dǎo)致腫瘤轉(zhuǎn)移擴(kuò)散。CTC可提供腫瘤病灶的基因組變異、mRNA表達(dá)異常、蛋白質(zhì)組變化、細(xì)胞形態(tài)與功能等信息, 相對(duì)于其它標(biāo)志物更能全面系統(tǒng)地反映腫瘤病灶的分子病理信息。與傳統(tǒng)組織活檢相比,基于CTC檢測(cè)的液體活檢技術(shù)具有腫瘤分子信息全面、侵入性小、取樣方便、無(wú)放射性污染、成本低等優(yōu)勢(shì),已成為目前最具發(fā)展?jié)摿Φ哪[瘤無(wú)創(chuàng)診斷和實(shí)時(shí)療效監(jiān)測(cè)手段之一。
CTC液體活檢面臨的挑戰(zhàn)
由于CTC一般是以幾個(gè)到幾十個(gè)細(xì)胞存在于幾十億個(gè)正常細(xì)胞之中,臨床進(jìn)行CTC分析鑒定猶如大海撈針,挑戰(zhàn)巨大。
成果簡(jiǎn)介
有鑒于此,楊朝勇教授團(tuán)隊(duì)提出了基于流體力學(xué)分離與仿生多價(jià)識(shí)別的微流控芯片多尺度協(xié)同捕獲富集新策略。
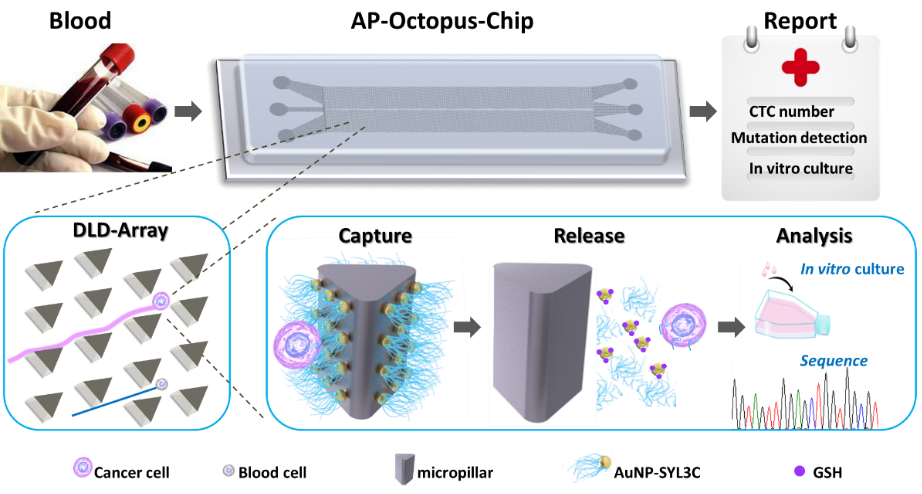
圖1. 仿生章魚芯片工作原理圖。外周血可直接通入芯片,腫瘤細(xì)胞不斷與三角形微柱碰撞并被章魚狀探針抓獲,而血細(xì)胞直接穿過(guò)而不被保留。被抓獲的腫瘤細(xì)胞可被無(wú)損釋放,用于下游用藥篩選、DNA測(cè)序分析等,為臨床提供精準(zhǔn)分子水平信息。
要點(diǎn)1:仿生章魚微流控芯片的設(shè)計(jì)
研究團(tuán)隊(duì)設(shè)計(jì)的仿生章魚微流控芯片由上萬(wàn)個(gè)修飾有可以特異捕獲CTC的核酸適體探針的微柱構(gòu)成,這些微柱陣列可在微米尺度上實(shí)現(xiàn)細(xì)胞尺寸選擇性流體力學(xué)調(diào)控。大尺寸的CTC可與微柱反復(fù)碰撞接觸而增加被探針抓住的機(jī)會(huì),而正常細(xì)胞因尺寸較小沿液流方向運(yùn)動(dòng)且很少與微柱碰撞而避免被誤抓。
在納米尺度上,每個(gè)微柱表面布滿了金納米顆粒,且每個(gè)金納米上修飾了上百條核酸適體探針。這些核酸適體像章魚的觸手捕食一樣可以相互協(xié)作,捕獲效率相比于單價(jià)的核酸適體提高3倍,從而實(shí)現(xiàn)CTC的高效率捕獲。捕獲后的細(xì)胞可以通過(guò)加入生物兼容性好的谷胱甘肽分子進(jìn)行配體交換反應(yīng),使核酸適體從納米界面上脫落,從而保證了CTC無(wú)損釋放,實(shí)現(xiàn)下游的細(xì)胞培養(yǎng)及基因突變檢測(cè)。
要點(diǎn)2:微流控芯片的CTC液體活檢
通過(guò)對(duì)正常人、結(jié)腸癌、前列腺癌臨床41例樣本的盲測(cè),該團(tuán)隊(duì)驗(yàn)證了所發(fā)展的芯片技術(shù)僅需1 mL外周血就可以有效區(qū)分腫瘤患者和正常人。特別是其中一例病人通過(guò)血液PSA和B超等臨床診斷為前列腺增生,而所發(fā)展的芯片技術(shù)在其外周血中捕獲到CTC,最終該名患者在尿道前列腺激光剜除術(shù)后病理判斷為偶發(fā)性前列腺癌(T1N0M0期)。這一病例體現(xiàn)了該方法的準(zhǔn)確性。
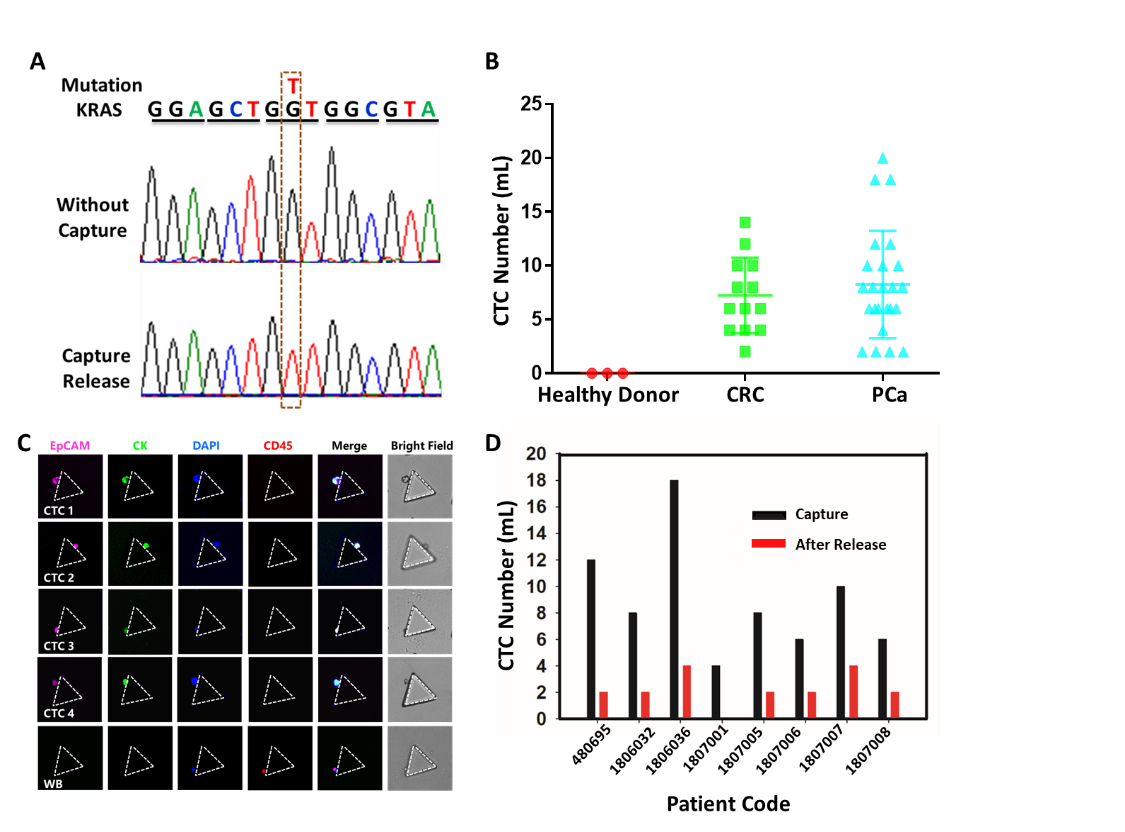
圖2. A)KRAS基因突變檢測(cè)。B) 正常人、結(jié)腸癌、前列腺癌樣品外周血CTC捕獲結(jié)果。C)部分病人CTC和白細(xì)胞熒光染色照片。D)癌癥患者CTC釋放情況。
小結(jié)
這種基于流體力學(xué)分離與仿生多價(jià)識(shí)別的多尺度協(xié)同循環(huán)腫瘤細(xì)胞捕獲富集新策略,在微米尺度上實(shí)現(xiàn)CTC選擇性增頻碰撞,在納米尺度上實(shí)現(xiàn)核酸適體多價(jià)協(xié)同捕獲,不僅提高捕獲效率,同時(shí)改善捕獲純度。該工作在腫瘤分期診斷、動(dòng)態(tài)監(jiān)測(cè)、療效評(píng)估、藥物開(kāi)發(fā)和預(yù)后監(jiān)測(cè)等方面有廣闊的應(yīng)用前景。
參考文獻(xiàn):
Song Y, Shi Y, Huang M, et al. BioinspiredEngineering of Multivalent Aptamer‐Functionalized Nanointerface to EnhanceCapture and Release of Circulating Tumor Cells. Angewandte Chemie InternationalEdition, 2018.
DOI: 10.1002/anie.201809337
https://onlinelibrary.wiley.com/doi/10.1002/anie.201809337











