
納米人編輯部對(duì)2018年國(guó)內(nèi)外重要科研團(tuán)隊(duì)的代表性重要成果進(jìn)行了梳理。今天,我們要介紹的是蘇州大學(xué)先進(jìn)生物材料與納米醫(yī)學(xué)實(shí)驗(yàn)室的劉莊教授課題組。
劉莊教授課題組近年來(lái)主要致力于生物材料與轉(zhuǎn)化醫(yī)學(xué)領(lǐng)域的研究,圍繞腫瘤診療中的若干挑戰(zhàn)性問題,發(fā)展了一系列新型納米探針用于體外生物檢測(cè)與活體分子影像,并探索了多種基于納米技術(shù)和生物材料的腫瘤光學(xué)治療、放射治療、與免疫治療新策略。
2018年,劉莊教授入選教育部“長(zhǎng)江學(xué)者” 特聘教授,入選中組部萬(wàn)人計(jì)劃 “領(lǐng)軍人才”,入選 Periodic Table of YoungerChemists-IUPAC。除此之外,劉莊教授再一次入選科睿唯安(Clarivate Analytics)年度“高被引科學(xué)家”,入選學(xué)科橫跨化學(xué)、材料科學(xué)、物理三大學(xué)科,這在整個(gè)入選名單中都屬于鳳毛麟角。
下面,我們簡(jiǎn)要介紹劉莊教授課題組2018年部分重要成果,供大家交流學(xué)習(xí)。
1)僅限于通訊作者文章,以online時(shí)間為準(zhǔn)。
2)由于學(xué)術(shù)有限,所選文章及其表述如有不當(dāng),敬請(qǐng)批評(píng)指正。
1. 基于生物材料的放射免疫聯(lián)合治療新策略 | Nature Biomedical Engineering
在對(duì)抗癌癥的這場(chǎng)持久戰(zhàn)中,人們夢(mèng)寐以求的是能有一種療法既能清除原發(fā)性的腫瘤、又能抑制腫瘤轉(zhuǎn)移甚至還能預(yù)防腫瘤的復(fù)發(fā)。然而,實(shí)現(xiàn)此功能并非易事。現(xiàn)如今,醫(yī)院里治療癌癥的“三板斧”仍然是手術(shù)、化療和放療。
但是,腫瘤一旦發(fā)生轉(zhuǎn)移,手術(shù)很難徹底清除轉(zhuǎn)移后的腫瘤細(xì)胞,而局部放療對(duì)于轉(zhuǎn)移后的腫瘤通常也無(wú)能為力,化療則有相當(dāng)大的副作用且容易誘發(fā)細(xì)胞耐藥。腫瘤免疫療法是一種新興的腫瘤治療策略,近年來(lái)得到了國(guó)際上極高的關(guān)注。
有鑒于此,蘇州大學(xué)劉莊教授團(tuán)隊(duì)和楊凱副教授團(tuán)隊(duì)合作,報(bào)道了一種基于生物材料的放射免疫聯(lián)合治療新策略。
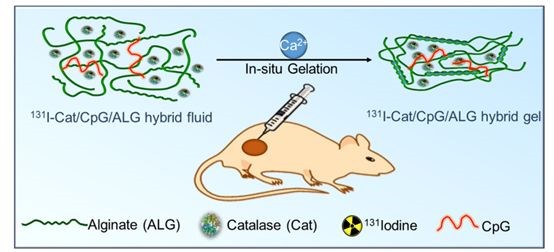
該研究將有治療功能的放射性同位素碘131標(biāo)記在過氧化氫酶上,然后將其與免疫佐劑CpG以及海藻酸鈉均勻混合得到復(fù)合注射液。在這個(gè)體系中,過氧化氫酶可以高效地分解腫瘤組織間的內(nèi)源性過氧化氫產(chǎn)生氧氣,通過改善腫瘤乏氧以增強(qiáng)放療療效;CpG作為免疫佐劑,可以與內(nèi)放療摧毀腫瘤后其殘留物中的腫瘤相關(guān)性抗原相互作用,產(chǎn)生腫瘤特異性的免疫反應(yīng);而海藻酸鈉在局部注射到腫瘤內(nèi)后,可以和腫瘤細(xì)胞間隙液中的鈣離子結(jié)合快速形成凝膠,將碘131標(biāo)記的過氧化氫酶固定在腫瘤內(nèi),從而增強(qiáng)其效果并且降低對(duì)正常器官的輻射副作用。
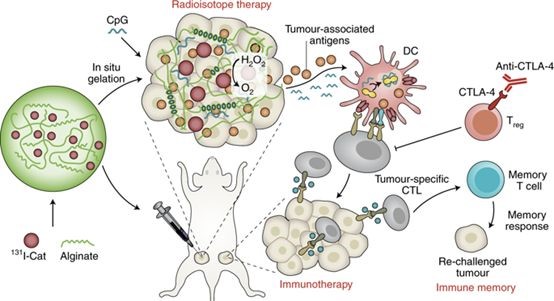
“將天然的生物材料作為紐帶聯(lián)合放射性同位素治療和腫瘤免疫治療,也許可以在摧毀可見實(shí)體腫瘤的同時(shí)消除轉(zhuǎn)移的隱匿腫瘤病灶并且預(yù)防其復(fù)發(fā)。”劉莊教授如是說(shuō)。
這種方法可以應(yīng)用于腫瘤介入放射治療來(lái)治療多種類型的實(shí)體瘤,給那些處于發(fā)生腫瘤轉(zhuǎn)移以及癌癥中晚期且不能通過手術(shù)或者化療治愈的患者或?qū)?lái)新的機(jī)遇。值得一提的是,該策略中使用的所有的試劑都是基于天然生物材料,具有很好的生物相容性和臨床轉(zhuǎn)化前景。
Chao Y,Xu L, Liang C, et al. Combined local immunostimulatory radioisotopetherapy and systemic immune checkpoint blockade imparts potent antitumourresponses. Nature Biomedical Engineering 2018
DOI: 10.1038/s41551-018-0262-6
https://www.nature.com/articles/s41551-018-0262-6
2. 一次注射但多次治療的腫瘤光熱-短距離放射治療 | ACS Nano
通過將治療性放射性物質(zhì)放入腫瘤或附近的區(qū)域中進(jìn)行治療的短距離放射治療。在這一治療方案中,生成的氧自由基被用于來(lái)攻擊生物分子如DNA,然后殺死腫瘤細(xì)胞。然而,由于實(shí)體腫瘤微環(huán)境的缺氧性質(zhì),乏氧的腫瘤細(xì)胞比正常細(xì)胞更能抵抗輻射,從而導(dǎo)致了這一治療方法對(duì)某些類型的癌癥的治療效果很差。此外,在一些臨床病例中,局部植入放射源例如125I可能無(wú)法為整個(gè)腫瘤提供同質(zhì)均勻的劑量分布,也會(huì)導(dǎo)致短距離放射治療效果不佳。
有鑒于此,蘇州大學(xué)劉莊教授課題組利用混合水凝膠體系,有效提高了CuS/131I的瘤內(nèi)保留并多次持續(xù)改善瘤內(nèi)乏氧來(lái)增強(qiáng)放射治療效果。
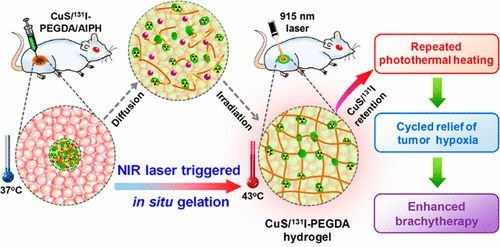
該課題組使用131I標(biāo)硫化銅(CuS/131I)納米粒子作為光熱-放射療法的試劑;聚乙二醇雙丙烯酸酯(PEGDA)作為聚合物基體;AIPH作為熱引發(fā)劑來(lái)實(shí)現(xiàn)光致原位凝膠光熱-短距離放射聯(lián)合治療腫瘤。CuS/131I在915nm激光輻照下會(huì)產(chǎn)生熱量適度地提高腫瘤溫度,并通過激活A(yù)IPH熱引發(fā)劑來(lái)啟動(dòng)PEGDA聚合,有效地通過原位凝膠化將CuS/131I固定在腫瘤內(nèi)。通過對(duì)腫瘤的反復(fù)照射,缺氧可以得到長(zhǎng)期有效的緩解,從而產(chǎn)生顯著的協(xié)同光熱效應(yīng)消除腫瘤。
活體治療實(shí)驗(yàn)表明,僅依靠PTT治療將無(wú)法有效地切除腫,因此相應(yīng)地這些組的小鼠在治療后僅有20-24天的壽命。同時(shí),利用CuS/131I NPs或CuS/ 131I-PEGDA/AIPH進(jìn)行單輪的近紅外激光治療,雖然顯示腫瘤增長(zhǎng)有被抑制,但在之后的效果也不明顯。而在小鼠腫瘤內(nèi)注射CuS/131I-PEGDA/AIPH和并且用三輪近紅外激光照射后發(fā)現(xiàn)腫瘤迅速縮小,最終在第 10天消失。
總之,這一工作開發(fā)出一種高效的NIR激活的混合水凝膠系統(tǒng)CuS/131I-PEGDA /AIPH,改善了短距離放射療法的效果并減少了副作用,為推動(dòng)這一療法的應(yīng)用提供了新的思路。
Meng Z, Chao Y, et al.Near-Infrared-Triggered in situ Gelation System for Repeatedly EnhancedPhotothermal-Brachytherapy with a Single Dose. ACS Nano 2018.
DOI: 10.1021/acsnano.8b04544
https://pubs.acs.org/doi/10.1021/acsnano.8b04544
3. 生物礦化中空納米顆粒多模成像指導(dǎo)腫瘤光動(dòng)力治療丨JACS
納米診療平臺(tái)的開發(fā)可以同時(shí)改善診斷和治療性能,同時(shí)減少副作用,對(duì)于精準(zhǔn)癌癥醫(yī)學(xué)而言極具吸引力。2018年,劉莊、馮良珠團(tuán)隊(duì)及其合作者發(fā)展了一種生物礦化中空納米顆粒多功能納米診療平臺(tái)。
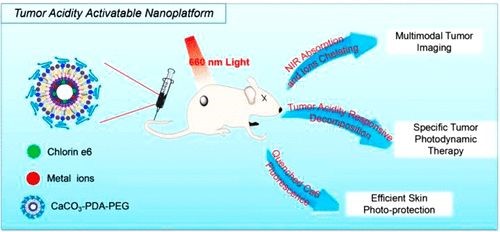
借助于氣體擴(kuò)散,研究團(tuán)隊(duì)發(fā)展了一種一步多巴胺介導(dǎo)的生物礦化方法,制備得到碳酸鈣 - 聚多巴胺(CaCO3-PDA)復(fù)合空心納米顆粒作為多功能治療診斷納米平臺(tái)。由于這種納米粒子對(duì)pH具有高靈敏度,可以在微酸性環(huán)境下快速降解,因此在pH值降低的情況下,負(fù)載的光敏劑(即由PDA淬滅的二氫卟吩e6(Ce6))的光活性在腫瘤內(nèi)增加。表現(xiàn)出可恢復(fù)的熒光和更多的單線態(tài)氧生成。此外,由于金屬離子與PDA之間的強(qiáng)親和力,納米粒子可以與各種類型的金屬離子結(jié)合,賦予它們多模態(tài)成像能力。利用pH響應(yīng)性多功能納米載體,研究人員實(shí)現(xiàn)了在多模態(tài)成像的精確指導(dǎo)下實(shí)現(xiàn)有效的體內(nèi)抗腫瘤光動(dòng)力療法(PDT)。有趣的是,在正常的生理pH下,這種納米粒子被淬滅并且對(duì)正常組織顯示出低得多的光毒性,因此有效地減少了PDT期間的皮膚損傷。總之,這項(xiàng)工作呈現(xiàn)了一種獨(dú)特類型的生物礦化診療納米顆粒,具有固有的生物相容性,多模式成像功能,高抗腫瘤PDT功效,并減少皮膚光毒性。
Ziliang Dong, LiangzhuFeng*, Zhuang Liu*. Synthesis of Hollow Biomineralized CaCO3–PolydopamineNanoparticles for Multimodal Imaging-Guided Cancer Photodynamic Therapy withReduced Skin Photosensitivity. J. Am. Chem. Soc., 2018, 140, 2165-2178.
4、Fenton催化劑和谷胱甘肽抑制劑增強(qiáng)腫瘤氧化應(yīng)激用于增強(qiáng)化療和放療 | Nano Lett.
增強(qiáng)細(xì)胞內(nèi)氧化應(yīng)激是誘導(dǎo)癌細(xì)胞死亡的一種有效方法。2018年12月28日,劉莊教授團(tuán)隊(duì)及其合作者報(bào)道了一種Fenton催化劑和谷胱甘肽抑制劑增強(qiáng)腫瘤氧化應(yīng)激用于增強(qiáng)化療和放療的新策略。
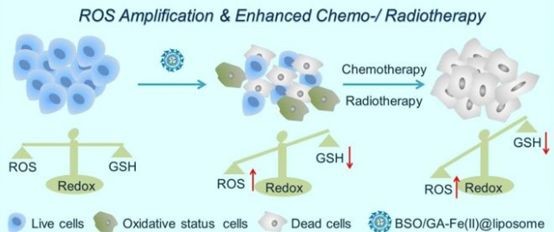
研究團(tuán)隊(duì)制備了一種獨(dú)特的超小沒食子酸-亞鐵(GA-Fe(II))納米配合物作為芬頓反應(yīng)的催化劑,使H2O2能夠持續(xù)轉(zhuǎn)化為高細(xì)胞毒性的羥基自由基(?OH)。然后,GA-Fe(II)和l -丁硫氨酸磺磷(BSO)(谷胱甘肽(GSH)合成的抑制劑)被共同封裝在一個(gè)脂質(zhì)體納米載體中來(lái)構(gòu)建BSO/GA-Fe(II)@脂質(zhì)體,它能夠通過增加?OH的生成和減少GSH的生物合成來(lái)有效地增強(qiáng)細(xì)胞內(nèi)氧化應(yīng)激。與99mTc4+放射性同位素螯合后,BSO/GA-Fe(II)@ 脂質(zhì)體可在單光子發(fā)射計(jì)算層析成像(SPECT)下進(jìn)行體內(nèi)成像跟蹤。GA-Fe(II)介導(dǎo)的?OH生成和BSO介導(dǎo)的GSH耗損會(huì)顯著增強(qiáng)腫瘤內(nèi)氧化應(yīng)激,從而顯著提高化療和放療的效果。
Dong, Z.L., Feng, L.Z. et al.Amplification of Tumor Oxidative Stresses with Liposomal Fenton Catalyst andGlutathione Inhibitor for Enhanced Cancer Chemotherapy and Radiotherapy.NanoLetters 2018.
DOI:10.1021/acs.nanolett.8b03905
https://pubs.acs.org/doi/10.1021/acs.nanolett.8b03905
5. 雙磷酸鈣納米材料用于增強(qiáng)放射性同位素治療癌癥 | ACS Nano
腫瘤相關(guān)巨噬細(xì)胞(TAMs)通常與放療的預(yù)后不良有關(guān)。因此,降低TAMs濃度是提高放療效果的一種很有前途的方法。2018年10月25日,劉莊和楊凱團(tuán)隊(duì)及其合作者介紹了一種生物相容性好的雙磷酸鈣基納米材料(CaBP-PEG)用于非螯合的放射性同位素治療(RIT),可以有效地減少TAMs的體內(nèi)消耗,進(jìn)行成像指導(dǎo)的增強(qiáng)的RIT。
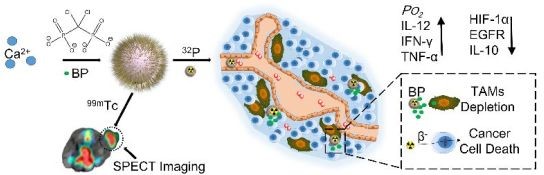
CaBP-PEG可以標(biāo)記上各種放射性同位素,例如99mTc以及用于RIT的 32P。SPECT成像證明CaBP(99mTc)-PEG具有良好的腫瘤富集。同時(shí)CaBP-PEG也具有降低TAMs、抑制血管生成、腫瘤血管正常化、增強(qiáng)瘤內(nèi)灌注和緩解腫瘤缺氧等作用。通過如此調(diào)節(jié)腫瘤微環(huán)境可以有利于RIT癌癥,具有良好的臨床應(yīng)用前景。
Tian, L.L., Yi, X. et al.Calcium Bisphosphonates Nanoparticles with ChelatorFree Radiolabeling toDeplete Tumor-Associated Macrophages for Enhanced Cancer Radioisotope Therapy. ACS Nano 2018.
DOI: 10.1021/acsnano.8b06699
https://pubs.acs.org/doi/10.1021/acsnano.8b06699
6. 光動(dòng)力免疫治療癌癥的智能納米反應(yīng)器| Nano Lett.
光動(dòng)力療法(PDT)是一種具有氧依賴性光觸發(fā)的無(wú)創(chuàng)療法,在癌癥治療中極具應(yīng)用前景。對(duì)于有效的PDT,通常需要納米級(jí)載體來(lái)實(shí)現(xiàn)光敏劑的腫瘤靶向遞送。理想情況下,最好是能夠靶向遞送到最易受活性氧物質(zhì)(ROS)影響的特定細(xì)胞器。其次,由于氧氣對(duì)PDT誘導(dǎo)的癌癥破壞至關(guān)重要,克服大多數(shù)實(shí)體瘤中存在的乏氧對(duì)于優(yōu)化PDT功效至關(guān)重要。有鑒于此,劉莊團(tuán)隊(duì)及其合作者發(fā)展了一種具有光動(dòng)力免疫治療效果的智能納米反應(yīng)器。
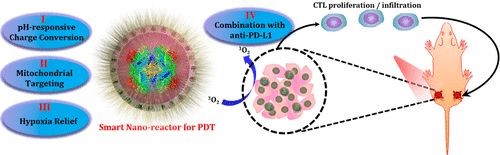
研究人員設(shè)計(jì)了一種獨(dú)特的酶包裹的,合理表面工程設(shè)計(jì)的,光敏劑負(fù)載的中空二氧化硅納米粒子作為智能納米反應(yīng)器。這種納米顆粒表面對(duì)pH具有響應(yīng)性,在酸性腫瘤微環(huán)境表現(xiàn)出增強(qiáng)的響應(yīng)保留,并且能夠進(jìn)一步靶向線粒體,即對(duì)ROS最敏感的細(xì)胞器。同時(shí),由納米反應(yīng)器引發(fā)的腫瘤內(nèi)源性H2O2的分解將導(dǎo)致腫瘤乏氧情況大大減輕,有利于體內(nèi)PDT。此外,通過將基于納米顆粒的PDT與檢查點(diǎn)阻斷療法相結(jié)合,可以實(shí)現(xiàn)全身性抗腫瘤免疫響應(yīng)以殺死1-2 cm遠(yuǎn)的未經(jīng)輻射的腫瘤,并有希望抑制腫瘤轉(zhuǎn)移。
GuangbaoYang , Bin Li* , Zhuang Liu*. Smart Nanoreactors for pH-Responsive TumorHoming, Mitochondria-Targeting, and Enhanced Photodynamic-Immunotherapy ofCancer. Nano Lett., 2018, 18, 2475–2484.
除此之外,劉莊教授課題組2018年在生物材料和轉(zhuǎn)化醫(yī)學(xué)領(lǐng)域還發(fā)表了一系列重要成果,由于內(nèi)容較多,在次不一一列出。感興趣的讀者可前往劉莊教授課題組網(wǎng)站學(xué)習(xí):http://nano.suda.edu.cn/lz/
課題組簡(jiǎn)介:

劉莊,蘇州大學(xué)教授,博士生導(dǎo)師 。2004年北京大學(xué)化學(xué)與分子工程學(xué)院獲理學(xué)學(xué)士學(xué)位;2008年美國(guó)斯坦福大學(xué)(Stanford University)獲得化學(xué)博士學(xué)位;2008年至2009年在斯坦福大學(xué)化學(xué)系以及醫(yī)學(xué)院從事博士后研究。2009年6月加入蘇州大學(xué)功能納米與軟物質(zhì)研究院,被聘為教授,博士生導(dǎo)師。
劉莊教授課題組當(dāng)前研究興趣包括開發(fā)新型功能納米材料,通過結(jié)構(gòu)設(shè)計(jì)、可控合成、和合理的表面修飾得到功能豐富的生物相容性納米材料,研究其在生命體系中的行為,并利用納米材料獨(dú)特的物理與化學(xué)性質(zhì)以發(fā)展新型多模態(tài)生物影像技術(shù)、靶向藥物輸送技術(shù)、以及腫瘤物理治療技術(shù),從而探索癌癥的診斷與治療的新思路與新方法。











