納米人編輯部對2018年國內外重要科研團隊的代表性重要成果進行了梳理。今天,我們要介紹的是中國科學院長春應用化學研究所稀土資源利用國家重點實驗室,化學生物學實驗室的曲曉剛研究員課題組。
曲曉剛研究員主要致力于化學與生物學交叉研究領域,研究方向包括化學調控生物分子構像與功能,藥物與靶分子作用機制,生物動力學及熱力學,生物功能材料等。主要成果包括:利用化學、生物物理、分子生物學、細胞學及材料化學等多學科交叉優勢,在對重要蛋白和基因識別、供能調控及潛在應用等方面做了大量系統的研究工作。為認識和調控重要的與疾病發生、發作相關的生物化學過程提供重要依據。
下面,我們簡要介紹曲曉剛研究員課題組2018年部分重要成果,供大家交流學習。
1)僅限于通訊作者文章,以online時間為準。
2)由于學術有限,所選文章及其表述如有不當,敬請批評指正。
1. 非均相鈀催化劑用于活細胞中的可逆光控生物正交催化 | Nature Commun.
作為化學生物學的有力工具,生物正交化學拓寬了探索生命之謎的途徑。在該領域中,過渡金屬催化劑因為可以快速催化生物酶無法實現的化學轉化而受到很多關注。然而,在生物系統中,精細控制化學反應仍然是一個巨大的挑戰。
2018年3月23日,曲曉剛研究員課題組報道了一種通過用偶氮苯(Azo)和β-環糊精(CD)的超分子復合物修飾Pd負載的大孔二氧化硅,以此來構建通用的光控生物正交催化劑。
沉積在大孔二氧化硅基底中的超小Pd納米顆粒在Pd介導的生物正交反應中具有優異的催化活性,通過模仿生物酶的變構調節機制,其催化活性可以通過光誘導的結構變化來調節。光控非均相過渡金屬催化劑對原位控制生物正交反應十分重要,并已成功用于通過Suzuki-Miyaura交叉偶聯反應合成用于細胞成像的熒光探針和線粒體特異性靶向劑。
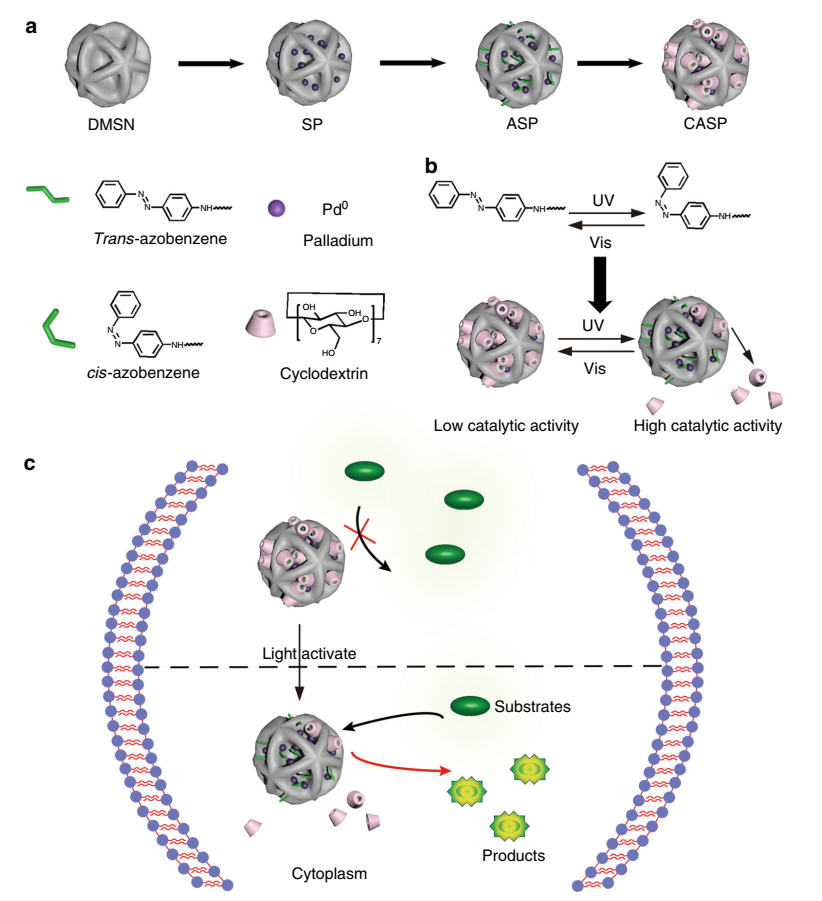
制備新功能的生物正交催化劑對于實現更復雜的生物化學研究具有重要意義。這項工作不僅為定制具有新功能的不同多相催化劑提供了新的視角,而且在前體藥物的活化和活性分子的合成方面具有巨大的潛力,可用于精確治療。根據需要,選擇性激活生物正交催化劑可以以最小化生物的干擾實現原位的多種化學反應。可以將材料設計為適用于活細胞中的各種化學反應,用于精確成像和治療。
Wang F, Zhang Y, et al. Designedheterogeneous palladium catalysts for reversible light-controlled bioorthogonalcatalysis in living cells.
Nature Communications, 2018.
DOI: 10.1038/s41467-018-03617-x
https://www.nature.com/articles/s41467-018-03617-x
2. 自組裝納米酶緩解缺氧并產生活性氧的腫瘤療法 | Nature Commun.
活性氧(ROS)誘導的細胞凋亡是治療惡性腫瘤的有效策略。然而,在缺氧腫瘤中,目前的體系高度依賴于腫瘤部位氧氣狀態或外部給予氧氣來產生ROS,這極大地限制了它們的治療功效。
2018年8月20日,曲曉剛和任勁松團隊合作開發了一種基于納米酶自組裝的仿生納米花,其可以在常氧和缺氧條件下催化過氧化氫分解產生ROS,而無需任何外部刺激。
在合成的MnO2上繼續生長PtCo納米顆粒,通過調節反應物的比例,得到具有優異催化效率且高度有序的MnO2@PtCo納米花,其中PtCo表現為氧化酶活性,MnO2表現為過氧化氫酶活性。通過這種方式MnO2@PtCo納米花不僅可以緩解缺氧條件,還可以通過ROS介導的機制顯著誘導細胞凋亡,從而對腫瘤生長產生顯著和特異性的抑制作用。
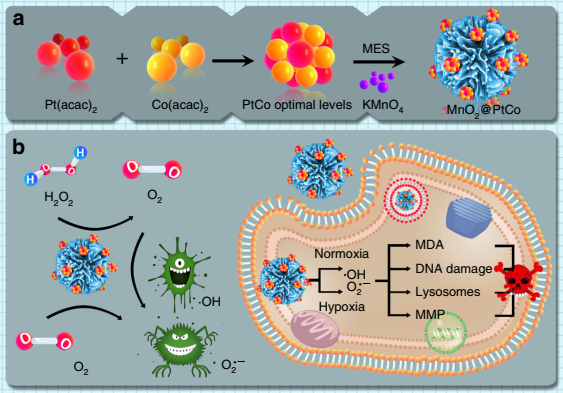
與傳統的ROS生成系統相比,所構筑的MnO2@PtCo納米花診療平臺具有以下優點:
(1)通過生物環境中發生的生物化學反應產生ROS,不需要外部激活,從而緩解了當前ROS介導的治療方式中存在的例如光穿透深度,超聲誘導的體溫過高和復雜的器械等問題;
(2)通過PtCo的氧化活性與MnO2的供氧能力的配合,MnO2@PtCo納米花能夠在缺氧腫瘤中有效緩解缺氧條件并產生ROS,從而產生顯著的治療效果;
(3)基于癌細胞比正常細胞更容易受到外源性ROS的影響,且MnO2@PtCo納米花的氧化能力依賴于酸性[pH(2.5-6.8)],MnO2@PtCo納米花可以優先誘導腫瘤細胞凋亡,但對主要器官的作用可以忽略不計。
總之,這項研究期望利用納米酶作為ROS產生源從而誘導細胞凋亡,開辟了一個激動人心的研究方向,設計和開發納米酶來通過細胞內酸性環境,以調節如遷移,分化,基因表達等細胞功能。
Wang Z, Zhang Y, et al. Biomimetic nanoflowers by self-assembly of nanozymes to induce intracellular oxidative damage against hypoxic tumors. Nature Communications, 2018.
DOI: 10.1038/s41467-018-05798-x
https://www.nature.com/articles/s41467-018-05798-x
3. 上轉換底物用于間質干細胞的光控誘導與多向分化 | Angew.
如何調控基質上間質干細胞(MSC)的分化對組織工程和再生醫學具有非常重要的意義。然而,目前大多數體系并不能像自然組織那樣控制MSCs的多向分化。
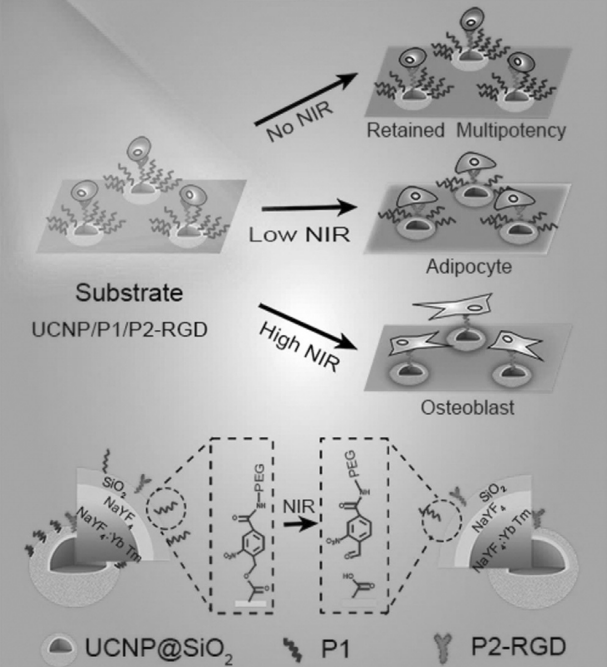
2018年7月23日,曲曉剛團隊及其合作者設計并構建了基于光調控的上轉換底物用于指導MSCs的多向分化。
由于附著在上轉換基質上的4-(羥甲基)-3-硝基苯甲酸修飾的聚(乙二醇)(P1)的抗粘附作用,MSC能夠維持其干細胞特征。在NIR照射后,通過光致斷裂將P1從底物中釋放出來。通過控制紅外激光強弱可以調控P1的分離比例并隨后改變細胞-基質相互作用,并且發現使用這種方法可以特異性地誘導在上轉換底物基板上培養的MSCs分化成脂肪細胞或成骨細胞。工作通過使用基于近紅外光的上轉換底物為調節MSC的多向分化提供了新的途徑。
Yan Z, Qin H, et al. Photocontrolled Multidirectional Differentiation of Mesenchymal Stem Cells on an Upconversion Substrate. Angewandte Chemie International Edition, 2018.
DOI: 10.1002/anie.201803939
https://onlinelibrary.wiley.com/doi/10.1002/anie.201803939
4. 仿生納米材料用于結腸癌聯合治療 | ACS Nano
利用葡萄糖氧化酶(GOx)來切斷葡萄糖的供應是饑餓治療癌癥的策略之一。然而,基于GOx的饑餓療法的體內應用受到了GOx遞送效率的限制。
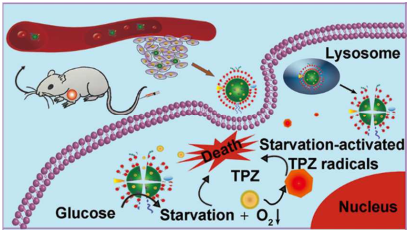
2018年9月28日,曲曉剛和任勁松團隊合作發展了一種仿生納米材料用于結腸癌聯合治療。
通過在紅細胞膜包裹的MOF中封裝GOx和前藥TPZ,研究人員制造了一種仿生納米材料TGZ@eM。合成的TGZ@eM可以幫助將GOx輸送到腫瘤細胞,然后耗盡內源性葡萄糖和O2來有效餓死腫瘤。并且由GOx饑餓療法引起的腫瘤缺氧進一步啟動了TPZ的激活用于增強結腸癌治療。通過仿生表面修飾,可以顯著提高這一納米材料的癌癥靶向能力。
Zhang L, Wang Z Z, et al.Erythrocyte Membrane Cloaked Metal-Organic Framework Nanoparticle as Biomimetic Nanoreactor for Starvation-Activated Colon Cancer Therapy. ACS Nano, 2018.
DOI: 10.1021/acsnano.8b05200
https://pubs.acs.org/doi/10.1021/acsnano.8b05200
5. 光調制的納米酶用于革蘭氏選擇性抗菌 | CM
雖然廣譜抗菌藥物已經被廣泛開發用于抗菌治療,但微生物菌群平衡的破壞會導致耐藥性的增加。為此,需要制定簡單有效的菌株選擇性殺菌策略。
2018年10月1日,曲曉剛團隊及其合作者設計了一種基于二硫化鉬和光酸分子的智能革蘭氏選擇性抗菌系統。
這個系統可以通過光來調制表面電荷轉換,同時通過改變pH來激活二硫化鉬的酶活性。考慮到不同的菌株細胞壁成分和結構差異,可以通過控制光照射時間來完成對革蘭氏選擇性抗菌。這一工作為通過簡單有效的光調節來實現選擇性抗菌提供了新的思路。
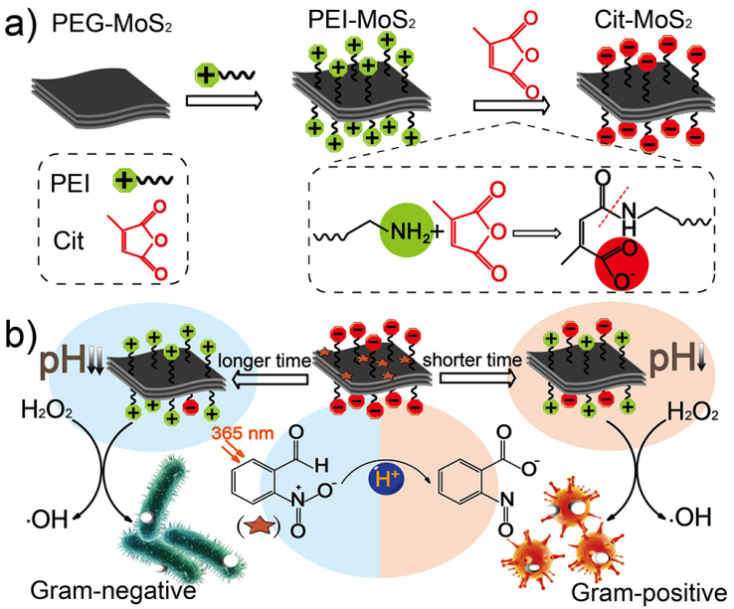
Niu J S, Sun Y H, et al.Photo-modulated Nanozyme Used for Gram-Selective Antimicrobial. Chemistry ofMaterials, 2018.
DOI:10.1021/acs.chemmater.8b02365
https://pubs.acs.org/doi/10.1021/acs.chemmater.8b02365
6. 超小納米酶結合多空碳骨架用于協同癌癥治療 | CM
納米酶是近年來最具前景的天然酶替代品之一。減小納米酶的尺寸可以產生更大的活性比表面積。但是所產生的更高表面自由能量也將會加劇納米酶的聚集甚至導致其喪失催化能力。
為了克服這些局限性,2018年10月9日,曲曉剛和任勁松團隊合作,發展了一種超小納米酶結合多空碳骨架用于協同癌癥治療的策略。
研究團隊首次使用了MOF材料作為載體來負載均勻分散的超小納米酶CeO2。這種MOF- CeO2材料具備氧化酶活性和除去ATP及氧化損傷的能力,特別是具有降低能量供給和高的藥物負荷能力。體內外的結果表明,這種納米結構在協同癌癥治療中具有很好的效果,其副作用也非常低,非常適用安全有效的癌癥治療。
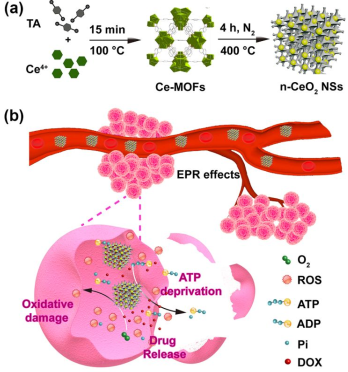
Cao F F, Zhang Y, et al.Ultrasmall Nanozymes Isolated within Porous Carbonaceous Frameworks for Synergistic Cancer Therapy: Enhanced Oxidative Damage and Reduced EnergySupply. Chemistry of Materials, 2018.
DOI:10.1021/acs.chemmater.8b03348
https://pubs.acs.org/doi/10.1021/acs.chemmater.8b03348
7. 介孔包封的手性納米金用于對映選擇性反應 | Angew.
雖然目前已經有很多科研工作者設計了各種納米材料用于生物催化,但很少有納米材料能夠以高選擇性和立體控制加速化學反應。這仍然使它們不再是天然酶的完美替代品。
受天然酶的啟發,2018年10月29日,曲曉剛團隊報道了一種對映選擇性納米材料,其中金納米顆粒(AuNP)作為活性中心,手性半胱氨酸(Cys)作為手性識別的選擇物,和擴展的中孔二氧化硅(EMSN)作為人工酶的骨架。
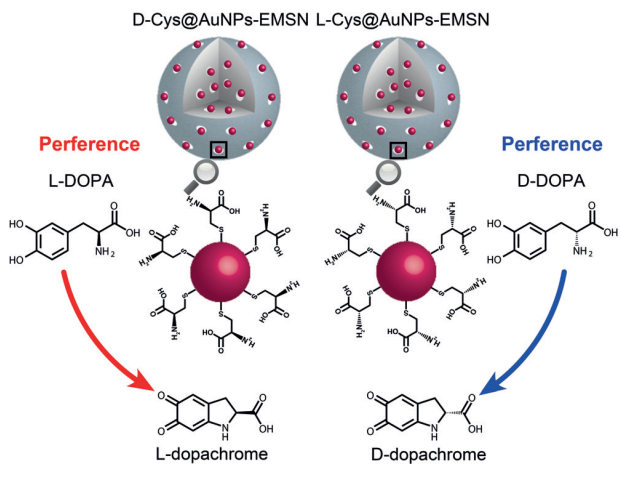
在手性3,4-二羥基-苯丙氨酸(DOPA)的氧化中,具有d-Cys的納米酶顯示出對l-DOPA的選擇性,而具有1-Cys的納米酶顯示出對d-DOPA的選擇性。隨后計算表觀穩態動力學參數和活化能以及分子動力學(MD)模擬表明,立體選擇性是由于手性Cys和DOPA之間氫鍵形成而沉淀的不同親和力決定的。納米酶基于天然酶設計并在催化中顯示出對映選擇性。這個概念可以擴展到其他人工酶,并可能促進其他立體選擇性酶模擬物的設計和構建。
Zhou Y, Sun H, et al. Mesoporous Encapsulated Chiral Nanogold for Use in Enantioselective Reactions. Angewandte Chemie International Edition, 2018.
DOI: 10.1002/anie.201811118
https://onlinelibrary.wiley.com/doi/10.1002/anie.201811118
除此之外,曲曉剛研究員課題組2018年在化學與生物學交叉研究領域還發表了一系列重要成果,由于內容較多,在此不一一列出。
曲曉剛研究員簡介

曲曉剛 中科院長春應化所研究員,博士生導師。國家杰青基金獲得者(2002),英國皇家化學會會士(FRSC),J. Mater. Chem. B副主編,J. Inorg. Biochem. 編委。
學習和工作經歷
1989-1995:中科院長春應化所研究生、獲生物電化學專業博士學位,中科院院長獎。師從董紹俊研究員(TWAS院士)和陸天虹研究員
1996-1999:美國Universily of Mississippi Medical Center, School of Medicine, J. B.Chaires教授
2000-2002:師從美國加州理工學院, NSF Laboratory for Molecular Sciences實驗室主任諾貝爾獎獲得者A H.Zewail教授
2006.12-2007.5:訪問美國UCSB諾貝爾獎獲得者Alan J. Heeger教授實驗室開展生物分子識別合作研究,部分結果已聯合發表
2002-至今:長春應化所稀土資源利用國家重點實驗室,化學生物學實驗室研究員,英國皇家化學會會士(FRSC),J. Mater. Chem. B副主編,J Inorg. Biochem.編委,吉林大學生科院兼職博士生導師,中國化學會生物物理化學專業委員會副主任,化學生物學專業委員會委員,中國稀土學會理事,中國生物物理學會理事。











