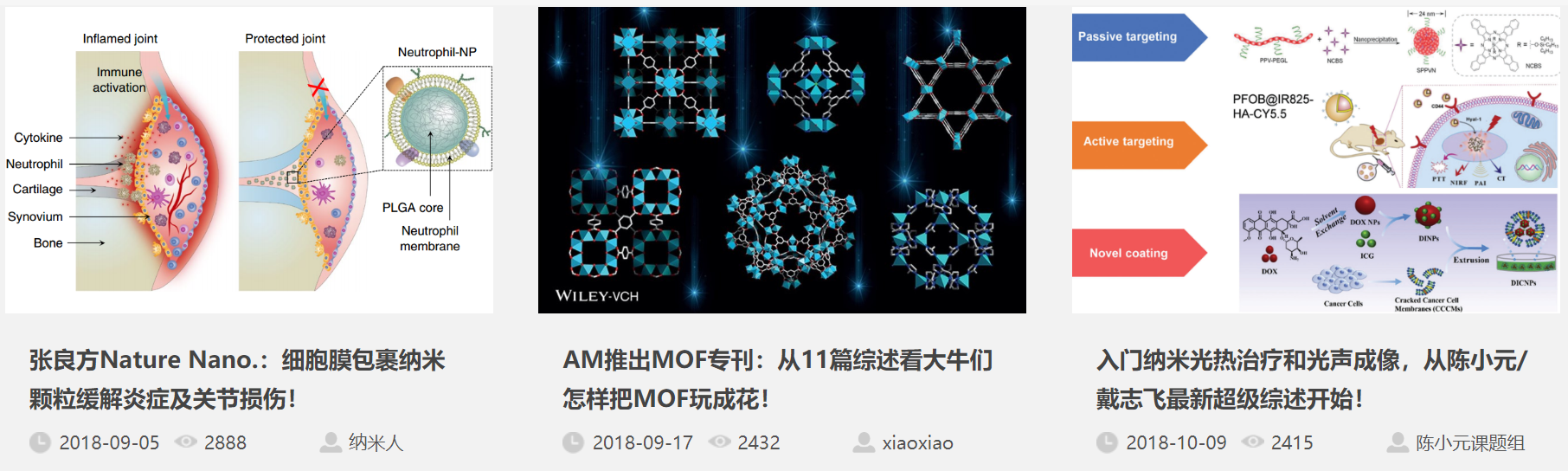
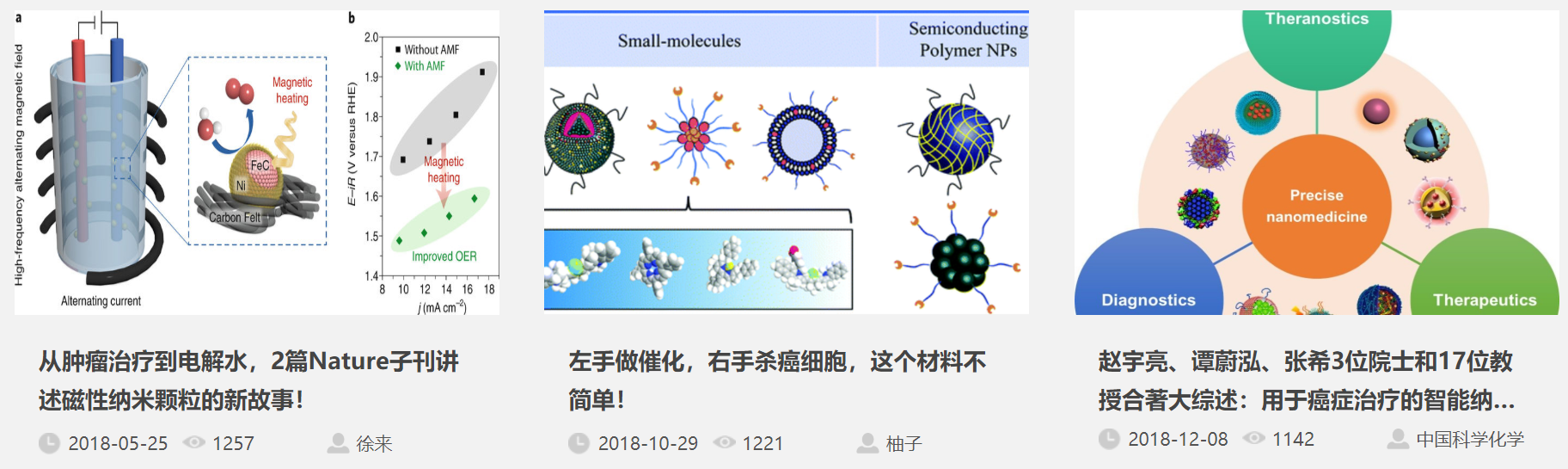
第一作者:Wantong Song
通訊作者:陳學(xué)思
通訊單位:中科院長(zhǎng)春應(yīng)化所
核心內(nèi)容:
1. 介紹了靶向模式識(shí)別受體(PRRs)來(lái)激活抗腫瘤免疫的基本概念。
2. 總結(jié)了基于生物材料的不同形式的PRRs激動(dòng)劑在腫瘤免疫治療中的最新進(jìn)展。
固有免疫應(yīng)答的優(yōu)勢(shì)
2018年,諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)授予美國(guó)的詹姆斯?艾利森(James Allison)與日本的本庶佑(Tasuku Honjo),以表彰他們?cè)诎┌Y免疫療法的貢獻(xiàn)。近年來(lái),腫瘤免疫治療取得了巨大成功,包括anti-PD-1、anti-PD-L1和anti-CTLA-4在內(nèi)的一大批免疫檢查點(diǎn)抑制劑類(lèi)藥物被應(yīng)用于臨床。雖然這些以T細(xì)胞為基礎(chǔ)的免疫療法在多種腫瘤上被證明是一種有效的策略,但是其總體響應(yīng)率很低。通過(guò)有效地激活腫瘤組織中的固有免疫應(yīng)答,將“冷”腫瘤轉(zhuǎn)變?yōu)椤盁帷蹦[瘤,有望實(shí)現(xiàn)腫瘤從免疫不響應(yīng)到免疫響應(yīng)的轉(zhuǎn)變。為此,近年來(lái)腫瘤免疫治療的關(guān)注點(diǎn)逐漸向固有免疫方面轉(zhuǎn)移。
介導(dǎo)固有免疫應(yīng)答的方式——靶向模式識(shí)別受體
固有免疫是機(jī)體應(yīng)對(duì)外來(lái)病原生物入侵的最初防衛(wèi)手段,表達(dá)在固有免疫細(xì)胞表面或胞內(nèi)的模式識(shí)別受體(pattern recognition receptors, PRRs)是介導(dǎo)固有免疫應(yīng)答的重要分子。利用多種天然或合成的小分子、核酸或蛋白類(lèi)免疫激動(dòng)劑靶向PRRs能夠有效激活固有免疫應(yīng)答,并進(jìn)一步促進(jìn)抗腫瘤免疫響應(yīng)。但是,PRR激動(dòng)劑的使用必須謹(jǐn)慎控制,否則會(huì)出現(xiàn)致命的毒副作用。
內(nèi)容簡(jiǎn)介
基于生物材料的納米制劑、凝膠及可植入支架等能夠通過(guò)緩控釋方式顯著降低PRR激動(dòng)劑的毒副作用,同時(shí)增強(qiáng)PRR激動(dòng)劑的免疫激活效果,為腫瘤免疫治療提供了新的發(fā)展方向。有鑒于此,中科院長(zhǎng)春應(yīng)化所陳學(xué)思團(tuán)隊(duì)介紹了靶向PRRs來(lái)激活抗腫瘤免疫的基本概念,并總結(jié)了基于生物材料的不同形式的PRRs激動(dòng)劑在腫瘤免疫治療中的最新進(jìn)展。
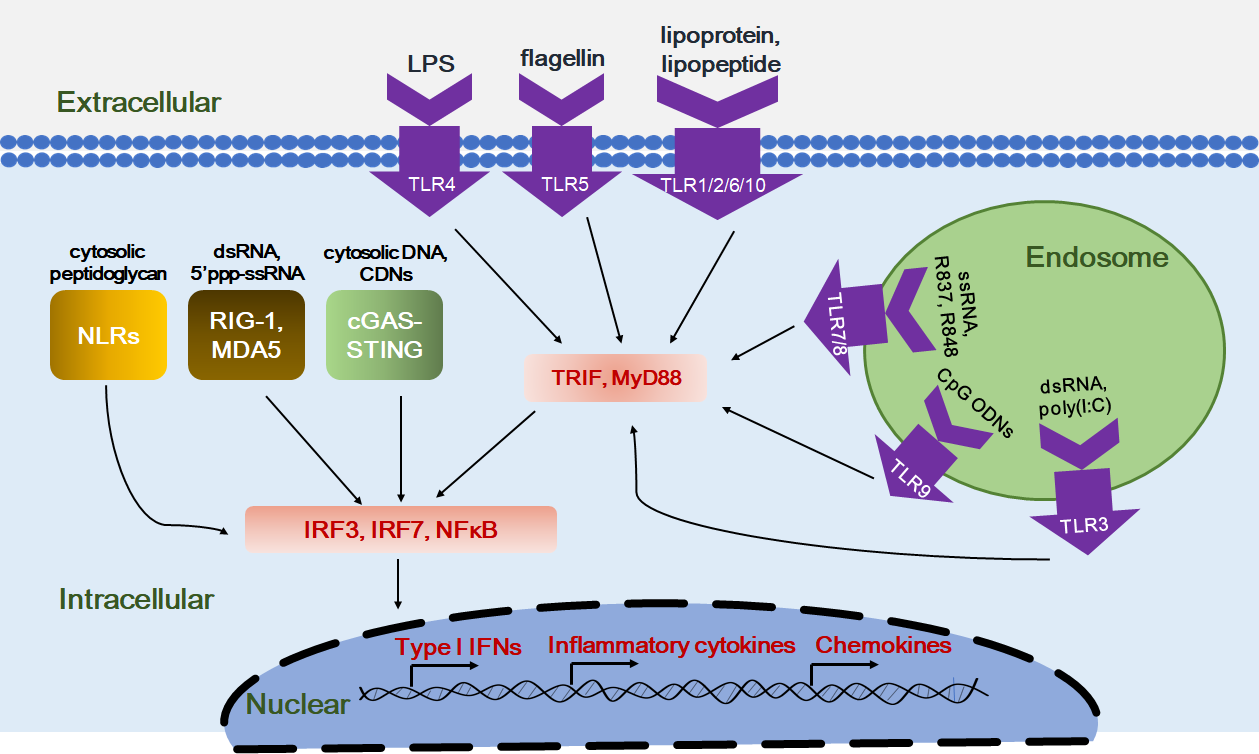
圖1. 各種模式識(shí)別受體、激動(dòng)劑及下游信號(hào)通路的總結(jié) [1]
要點(diǎn)1:靶向模式識(shí)別受體來(lái)激活抗腫瘤免疫
模式識(shí)別受體在機(jī)體識(shí)別外來(lái)病原體和危險(xiǎn)信號(hào)的過(guò)程中扮演了重要角色。PRRs包括多種受體家族,包括Toll樣受體(Toll-like receptors,TLRs)、NOD樣受體(NOD-like receptors,NLRs)、C型凝集素受體(C-typelectin receptors,CLRs)、RIG-I樣受體(RIG-I-like receptors,RLRs)和細(xì)胞質(zhì)DNA/RNA受體等。這些受體能夠識(shí)別脂多糖(LPS)、脂蛋白、鞭毛蛋白以及一些特定的核苷酸序列。一旦模式識(shí)別受體受到上述物質(zhì)刺激,就會(huì)啟動(dòng)炎癥相關(guān)基因的表達(dá),激活免疫系統(tǒng)以應(yīng)對(duì)感染或組織損傷(圖1)。
Toll樣受體是表達(dá)在抗原提呈細(xì)胞的細(xì)胞膜或內(nèi)涵體中的一類(lèi)跨膜蛋白,能夠識(shí)別來(lái)自病原微生物的相關(guān)抗原。Toll樣受體包括從TLR1到TLR13的13種受體類(lèi)型,其中TLR3、TLR7/8和TLR9在抗腫瘤研究中得到廣泛關(guān)注,其相應(yīng)的激動(dòng)劑包括poly(I:C),R837/R848,CpG ODNs等已被用于聯(lián)合腫瘤免疫治療的嘗試。
NOD樣受體能夠識(shí)別來(lái)自細(xì)胞間壓力的危險(xiǎn)信號(hào),代表性的NOD樣受體激動(dòng)劑如Mifamurtide已被歐盟批準(zhǔn)進(jìn)行非轉(zhuǎn)移性肉瘤的臨床試驗(yàn)。
C型凝集素受體是一類(lèi)跨膜蛋白受體,能夠識(shí)別微生物膜表面的多種多糖,其激動(dòng)劑如β-glucans作為輔助治療在多種動(dòng)物腫瘤模型上觀察到有益效果。
RIG-I樣受體與固有免疫系統(tǒng)識(shí)別病毒感染有關(guān),其激動(dòng)劑包括poly(I:C)等。
DNA通常位于細(xì)胞核內(nèi),當(dāng)細(xì)胞質(zhì)中出現(xiàn)DNA時(shí)會(huì)被認(rèn)為是病原體入侵的危險(xiǎn)信號(hào),此時(shí),細(xì)胞質(zhì)內(nèi)的DNA受體就會(huì)識(shí)別這些危險(xiǎn)信號(hào),啟動(dòng)進(jìn)一步的免疫響應(yīng)。基于此,以干擾素基因刺激蛋白(STING)為目標(biāo)的免疫激動(dòng)劑開(kāi)發(fā)也成為當(dāng)前腫瘤免疫治療研發(fā)的熱點(diǎn)。
要點(diǎn)2:以納米材料為基礎(chǔ)靶向模式識(shí)別受體
利用納米技術(shù)遞送PRR激動(dòng)劑具有多種優(yōu)勢(shì):納米顆粒通過(guò)EPR效應(yīng)可以促進(jìn)PRR激動(dòng)劑在腫瘤部位的富集;納米載體能夠防止不穩(wěn)定的PRR激動(dòng)劑降解并增加細(xì)胞對(duì)激動(dòng)劑的攝取;適當(dāng)粒徑和表面特性的納米顆粒能夠進(jìn)入腫瘤引流淋巴結(jié)并活化其中的DC細(xì)胞。
2.1 靶向TLR9的納米激動(dòng)劑
CpGODN是核酸類(lèi)TLR9激動(dòng)劑,其在血漿中易被降解且不易跨膜進(jìn)入細(xì)胞,這些都極大地限制了其直接使用激活TLR9受體的效果。通過(guò)靜電吸附或化學(xué)鍵合的方式,用納米技術(shù)傳輸CpG成為近年來(lái)研究的熱點(diǎn)。
本文總結(jié)了以下幾種傳輸CpG的方式:(1)CpG與PEI通過(guò)靜電作用制備納米復(fù)合物;(2)利用基于PEG的納米凝膠擔(dān)載CpG;(3)以PLGA為載體傳輸CpG;(4)以金納米顆粒為載體傳輸CpG;(5)以多孔材料為載體傳輸CpG;(6)以脂質(zhì)體為載體傳輸CpG;(7)用化學(xué)修飾的方法鍵合小分子或蛋白提高CpG的傳輸效率。通過(guò)上述幾種方式,有效提高了CpG的穩(wěn)定性和細(xì)胞內(nèi)吞,顯著增強(qiáng)了CpG的免疫激活效果。
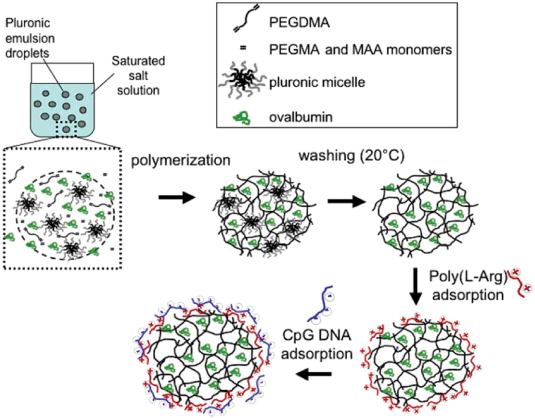
圖2. PEG基納米凝膠擔(dān)載CpG [2]
2.2 靶向TLR7/8的納米激動(dòng)劑
以咪唑喹啉為基礎(chǔ)的一類(lèi)小分子能夠作為T(mén)LR7/8的激動(dòng)劑,但其同樣面臨毒副作用大等問(wèn)題。通過(guò)以下傳輸手段增強(qiáng)了TLR7/8小分子激動(dòng)劑的作用效果同時(shí)減小了其毒副作用:(1)以化學(xué)改性的多糖,通過(guò)物理包埋或超分子作用擔(dān)載R837/R848;(2)以PLGA為載體擔(dān)載R848;(3)以金納米顆粒為載體擔(dān)載R848;(4)將TLR7/8激動(dòng)劑鍵合到高分子載體上來(lái)進(jìn)行傳輸;(5)將TLR7/8激動(dòng)劑鍵合到蛋白進(jìn)行傳輸。
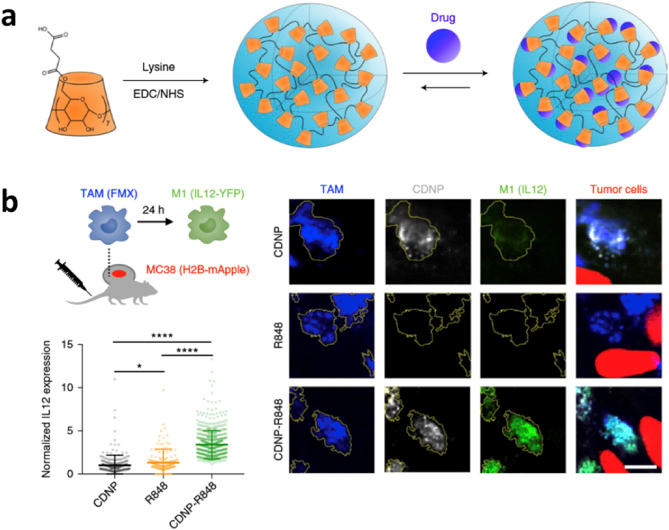
圖3. 設(shè)計(jì)β-環(huán)糊精納米顆粒,用于R848遞送以及腫瘤相關(guān)巨噬細(xì)胞“再教育” [3]
2.3 靶向STING的納米激動(dòng)劑
STING通路的受體位于細(xì)胞質(zhì)內(nèi),因此要實(shí)現(xiàn)有效的STING通路的激活,需要將激動(dòng)劑傳送到細(xì)胞質(zhì)中去。本文總結(jié)了STING激動(dòng)劑通過(guò)以下幾種方式進(jìn)行遞送:(1)以脂質(zhì)體為載體遞送;(2)以改性葡聚糖,PEI靜電復(fù)合物等為載體遞送。
這些遞送方式都有效防止了STING激動(dòng)劑的降解。例如,陽(yáng)離子脂質(zhì)體擔(dān)載的STING激動(dòng)劑cGAMP,有效增加了cGAMP進(jìn)入細(xì)胞的效率,同時(shí),由于STING通路的受體位于細(xì)胞質(zhì)中,陽(yáng)離子載體在被細(xì)胞內(nèi)吞后能夠有效促進(jìn)cGAMP向細(xì)胞質(zhì)中的釋放,更好地促進(jìn)了STING通路的激活。除此之外,有些合成材料本身被證明能夠促進(jìn)STING通路的激活,例如Luo等人合成的陽(yáng)離子聚合物材料可以直接激活STING通路發(fā)揮抗腫瘤作用。
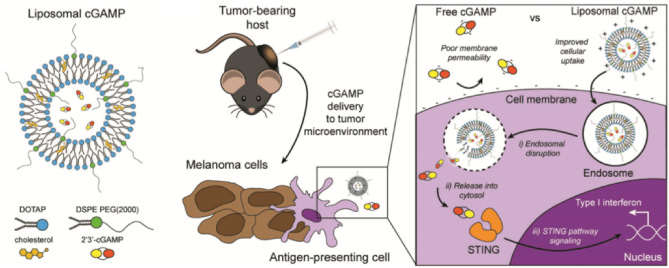
圖4. 脂質(zhì)體擔(dān)載的cGAMP的結(jié)構(gòu)以及作用機(jī)理 [4]
2.4 靶向其它PRR的納米激動(dòng)劑
除上述幾種常見(jiàn)的PRR靶點(diǎn)外,還有針對(duì)其它PRR受體的納米激動(dòng)劑被開(kāi)發(fā)出來(lái)。例如,Das等人以磷酸鈣納米粒傳輸RLRs的激動(dòng)劑pppRNA,在靜脈注射時(shí),單獨(dú)使用上述納米制劑可以有效抑制胰腺癌腫瘤的生長(zhǎng),而裸露的pppRNA則完全沒(méi)有腫瘤抑制效果。另外,多種PRR激動(dòng)劑聯(lián)合使用也是有效激活免疫響應(yīng)的一種方式,Sun等將Pam3CSK4, MPLA和R837等激動(dòng)劑共載,更好的發(fā)揮了免疫激活的效果。
要點(diǎn)3:利用生物材料局部緩釋模式識(shí)別受體激動(dòng)劑
生物可降解高分子材料被廣泛用于制備凝膠和支架,這些凝膠和支架作為局部藥物緩釋載體能夠?qū)崿F(xiàn)藥物的長(zhǎng)效釋放并有效降低系統(tǒng)毒性。常用的生物可降解高分子材料如PCL、葡聚糖、PEG等,都可以通過(guò)改性的方式制備支架擔(dān)載免疫激動(dòng)劑和免疫檢查點(diǎn)藥物,并被證明能夠有效地發(fā)揮抗腫瘤或防止腫瘤復(fù)發(fā)的作用。
基于DNA的凝膠體系越來(lái)越多地被用于免疫治療領(lǐng)域。DNA與陽(yáng)離子多糖混合制備的凝膠體系擔(dān)載CpG,有效防止了CpG在腫瘤內(nèi)的降解,并顯著增強(qiáng)了CpG的抗腫瘤效果。
模擬病原體感染招募免疫細(xì)胞的方式,也能夠有效激活免疫。通過(guò)將腫瘤抗原、TLR激動(dòng)劑和趨化因子共載入多孔硅支架,能夠有效招募DC細(xì)胞進(jìn)入支架攝取腫瘤抗原,取得了顯著的抗腫瘤效果。
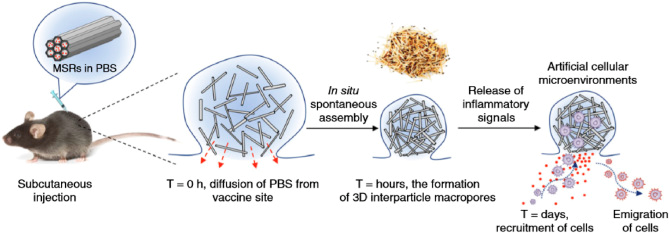
圖5. 通過(guò)體內(nèi)自發(fā)組裝形成的多孔硅支架用于細(xì)胞招募 [5]
總結(jié)與展望
由于腫瘤的免疫抑制微環(huán)境,導(dǎo)致腫瘤中的新生抗原無(wú)法被免疫細(xì)胞識(shí)別。通過(guò)外源介入的方法可以激活腫瘤的免疫微環(huán)境從而產(chǎn)生有效的抗腫瘤效果。PRR激動(dòng)劑雖然已經(jīng)被廣泛應(yīng)用于腫瘤疫苗的研究,但仍面臨易降解,毒副作用大等問(wèn)題。基于生物材料的靶向遞送技術(shù)無(wú)疑為PRR激動(dòng)劑的抗腫瘤治療增添了強(qiáng)大動(dòng)力。
未來(lái),基于生物材料的PRR激動(dòng)劑仍有許多值得思考的問(wèn)題,首先,深入發(fā)掘基于生物材料的PRR激動(dòng)劑的作用機(jī)制,探索更有效的給藥方式,有望開(kāi)發(fā)出更有效的腫瘤免疫治療制劑;其次,針對(duì)免疫激活過(guò)程的需求,設(shè)計(jì)智能響應(yīng)性生物材料來(lái)進(jìn)一步發(fā)揮PRR激動(dòng)劑的效果,都是值得進(jìn)一步探索的方向。
參考文獻(xiàn):
SongW, Das M, Xu Y, Si X, Zhang Y, Tang Z, Chen X. Leveraging Biomaterials forCancer Immunotherapy: Targeting Pattern Recognition Receptors. Materials TodayNano, 2019.
DOI:10.1016/j.mtnano.2019.100029
https://www.sciencedirect.com/science/article/pii/S2588842019300082?via%3Dihub
參考文獻(xiàn):
[1]SongW, Das M, Xu Y, Si X, ZhangY, Tang Z, Chen X. Leveraging Biomaterials forCancer Immunotherapy: TargetingPattern Recognition Receptors. MaterialsToday Nano, 2019, 5, 100029.
[2] Jain, S.; Yap, W.T.; Irvine, D. J. Synthesis of protein-loaded hydrogel particles in an aqueoustwo-phase system for coincident antigen and CpG oligonucleotide delivery toantigen-presenting cells. Biomacromolecules2005, 6, 2590-600.
[3] Rodell, C. B.; Arlauckas, S. P.; Cuccarese,M. F.; Garris, C. S.; Li, R.; Ahmed, M. S.; Kohler, R. H.; Pittet, M. J.;Weissleder, R. TLR7/8-agonist-loaded nanoparticles promote the polarization oftumour-associated macrophages to enhance cancer immunotherapy. Nature Biomedical Engineering 2018, 2,578-588.
[4] Koshy, S. T.; Cheung, A.S.; Gu, L.; Graveline, A. R.; Mooney, D. J. Liposomal Delivery Enhances ImmuneActivation by STING Agonists for Cancer Immunotherapy. Advanced Biosystems 2017, 1, 1600013.
[5]Kim, J.; Li, W. A.; Choi, Y.; Lewin, S. A.;Verbeke, C. S.; Dranoff, G.; Mooney, D. J. Injectable, spontaneouslyassembling, inorganic scaffolds modulate immune cells in vivo and increasevaccine efficacy. Nature biotechnology 2015,33, 64-U241.
更多腫瘤免疫技術(shù)前沿進(jìn)展,請(qǐng)進(jìn)入納米人官網(wǎng)查看:
www.pswbw.com