每周一期,帶你了解最新的納米生物醫學前沿進展。由于學識有限,不能包羅所有,歡迎大家推薦或者投稿(inaoner@163.com),歡迎提意見!
1. AM:人造超級中性粒細胞用于炎癥靶向和產生次氯酸對抗腫瘤和感染
中性粒細胞是一種功能強大的效應性白細胞,在天然免疫系統中發揮著重要的作用。武漢大學張先正教授團隊設計了一種人工超級中性粒細胞,它具有良好的炎癥靶向性和生成次氯酸(HClO)的能力,可以被用于靶向和消除惡性腫瘤細胞及病原體。實驗將葡萄糖氧化酶(GOx)和氯過氧化物酶(CPO)包埋在ZIF-8中用于生成HClO,再利用中性粒細胞膜(NM)對其進行包裹從而制備了這種超級中性粒細。體外和體內實驗結果表明,這種人工合成的超級中性粒細胞在消除腫瘤和感染方面的能力是天然中性粒細胞的7倍,由此表明超級中性粒細胞具有巨大的生物醫學應用價值和潛力。
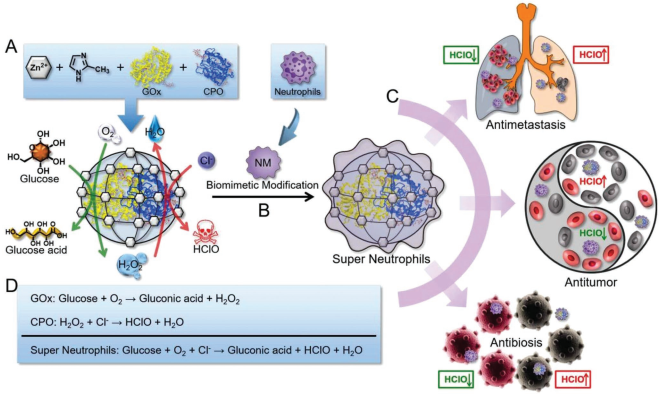
Zhang, C., Zhang, X.Z. et al. Artifcial Super Neutrophils for Inflammation Targeting and HClO Generationagainst Tumors and Infections. Advanced Materials, 2019.
DOI: 10.1002/adma.201901179
https://doi.org/10.1002/adma.201901179
2. Angew:尺寸小、可共軛、正交可調的熒光團用于對細胞代謝的體內成像
代謝產物的運輸和囊泡轉運過程對于維持活細胞的正常功能來說至關重要。然而由于缺乏熒光化學結構,目前還無法在高時空分辨率和生理條件下直接監測小的代謝產物,這也給原位代謝成像研究也造成了很大阻礙。愛丁堡大學Marc Vendrell教授團隊制備了一種尺寸小、可共軛、正交可調的熒光團SCOTfluors,它可以被用于實時跟蹤活細胞內和體內的基本代謝物以及了解不同來源的人類癌細胞的代謝情況。
Benson, S., Fernandez, A., Vendrell, M.et al. SCOTfluors: Small, Conjugatable, Orthogonal and Tunable Fluorophores forin vivo Imaging of Cell Metabolism. Angewandte Chemie International Edition, 2019.
DOI: 10.1002/anie.201900465
http://dx.doi.org/10.1002/anie.201900465
3. Small:化學發光納米傳感器實時反映炎癥大鼠體內的超痕量單線態氧
由于非輻射誘導的單態氧(1O2)只具有微秒級的壽命和組織中大量的還原劑對其產生猝滅作用,要實現對整個動物體內的單態氧(1O2)的檢測被認為具有很大挑戰性。陜西師范大學趙娜團隊和呂家根教授團隊報道了一種化學發光(CL)納米傳感器NTPE-PH,該傳感器利用分子內的能量傳遞機制,具有很高的能量傳遞效率和聚合誘導的發射行為,從而保證了高的CL放大效果并對納摩爾級別的1O2十分敏感。該方法也具有較低的細胞毒性和良好的生物相容性,可以實現對急性和慢性炎癥動物體內超痕量的1O2進行實時定位,因此NTPE-PH傳感器可作為一種在不同的免疫反應、病理過程甚至是藥物治療中監測1O2變化的有效工具。
Zhang, S.H., Zhao, N., Lv, J.G. et al.Real-Time Mapping of Ultratrace Singlet Oxygen in Rat during Acute and Chronic In?ammationsvia a Chemiluminescent Nanosensor. Small, 2019
DOI: 10.1002/smll.201804662
https://doi.org/10.1002/smll.201804662
4. AM綜述:調節有機/聚合物光學試劑的光物理性質用于癌癥光學診療
光學試劑的光物理性質與其生物醫學功能和效率密切相關。南開大學丁丹教授團隊綜述了有關有機/聚合物光學試劑的最新研究進展;主要介紹了通過調整這些試劑的光物理性質以實現更好的癌癥光學診療應用的策略;討論了通過納米工程和分子設計兩種方法來優化其生物醫學功能的具體方法。

Chen, H., Ding, D. et al. Regulating the Photophysical Property of Organic/Polymer Optical Agents for Promoted Cancer Phototheranostics. Advanced Materials, 2019.
DOI: 10.1002/adma.201806331
https://doi.org/10.1002/adma.201806331
5. Adv. Sci.:光解金黃色葡萄球菌中的葡萄球菌黃素來增強活性氧的殺滅作用
對抗耐甲氧西林的金黃色葡萄球菌(MRSA)感染已成為一項嚴峻的任務。波士頓大學程繼新教授團隊和普渡大學Mohamed N. Seleem教授團隊合作報道了一種通過光解金黃色葡萄球菌膜內的抗氧化劑葡萄球菌黃素來治療MRSA的方法。通過光解金黃色葡萄球菌中的葡萄球菌黃素可以短暫地提高膜的通透性,使MRSA更加容易受到過氧化氫的攻擊。因此,在460 nm光照射下葡萄球菌黃素會發生光解,可以與過氧化氫和其他活性氧發揮協同作用,進而徹底清除MRSA。這種協同治療的有效性在被MRSA感染的巨噬細胞、金黃色葡萄球菌生物膜和兩種小鼠感染傷口等眾多模型中得到了很好的驗證。這一研究表明光解葡萄球菌黃素可以作為協同治療MRSA感染的一種新的策略。

Dong, P.T., Seleem, M.N., Cheng, J.X. etal. Photolysis of Staphyloxanthin in Methicillin-Resistant Staphylococcusaureus Potentiates Killing by Reactive Oxygen Species. Advanced Science, 2019.
DOI: 10.1002/advs.201900030
https://doi.org/10.1002/advs.201900030
6. Small:具有聚集誘導發射特性的有機近紅外II區熒光團用于體內成像
設計和合成在近紅外II區(NIR-II, 1000-1700 nm)發射的新型熒光團可以大大促進體內熒光成像的發展。有機近紅外II區探針因其良好的穩定性和生物相容性而受到研究人員的廣泛關注,具有很好的臨床轉化價值。然而,有機近紅外II區熒光劑的量子產率往往較低,設計也很復雜。南京工業大學劉杰教授團隊、第三軍醫大學諶小維教授團隊和馮華教授團隊通過改變一種近紅外I區聚集誘導發射(AIE) 熒光體(AIEgen)的受體單元的單個原子,使其吸收光譜和發射光譜發生紅移。這種新制備的AIEgen(L897 NPs)具有延伸至1200納米的發射,其量子產率也高達5.8%,以此為基礎可以實現具有高信噪比、深穿透的無創血管成像和淋巴成像。此外,L897NPs也具有較高的腫瘤/正常組織比,可作為一種用于腫瘤成像和手術導航的良好造影劑。

Wu, W., Chen, X.W., Liu, J., Feng, H. etal. Molecular Engineering of an Organic NIR-II Fluorophore with Aggregation-Induced Emission Characteristics for In Vivo Imaging. Small, 2019.
DOI: 10.1002/smll.201805549
https://doi.org/10.1002/smll.201805549
7. Nature Commun.:半固態前藥納米顆粒用于遞送抗逆轉錄病毒藥物和聯合治療HIV
據估計,全球目前感染人類免疫缺陷病毒(HIV)的人數為3670萬。終生服用抗逆轉錄病毒(ARV)藥物可通過抑制循環病毒載量使HIV成為一種慢性病,從而使生活接近正常;然而,每日口服藥物也會導致耐藥性等副作用的產生。因此,設計長效(LA)的、納米級別的、難溶于水的抗逆轉錄病毒藥物具有非常好的臨床應用價值,其在被單次注射后的幾個月時間內可以保持效用不變。約翰霍普金斯大學醫學院Caren Freel Meyers教授團隊和利物浦大學Steve P. Rannard教授團隊設計了一種半固態前藥納米顆粒(SSPNs)用于遞送高水溶性的核苷逆轉錄酶抑制劑(NRTI)恩曲他濱(FTC)。體內外的外推(IVIVE)模型證明了該體系可以實現持續的前藥釋放,并隨后在相關的生物環境中被激活進行治療。
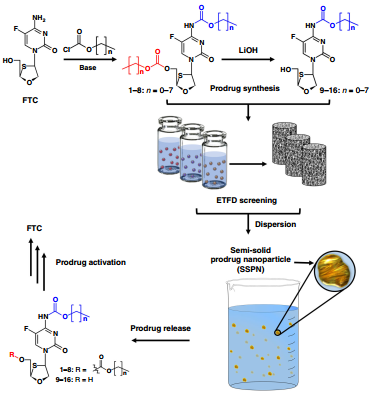
Hobson, J.J., Meyers, C.F., Rannard, S.P.et al. Semi-solid prodrug nanoparticles for long-acting delivery of water-solubleantiretroviral drugs within combination HIV therapies. Nature Communications, 2019.
https://doi.org/10.1038/s41467-019-09354-z
8. JACS:用于檢測癌細胞和腫瘤中溶酶體甲醛含量的雙“鎖鑰”釕復合探針
生物醫學研究表明,過量的甲醛生成是造成組織癌變、癌癥進展和轉移的關鍵因素之一。響應性分子探針可以檢測活細胞和腫瘤中溶酶體內的甲醛,并對藥物引發的甲醛清除過程進行監測,這也有助于未來的癌癥診斷和治療監測。大連理工大學張文珠團隊、袁景利團隊和昆士蘭大學張潤團隊合作報道了一種新型的基于雙“鎖鑰”策略的釕(II)復合探針Ru-FA用于體內外甲醛檢測。由于Ru(II)中心向吸電子基團2,4-二硝基苯(DNB)的光致電子轉移(PET)過程,Ru-FA具有微弱的發光。在酸性微環境中(第二個鑰匙)的探針會與甲醛發生特異性反應(第一個鑰匙),Ru- FA會裂解產生DNB并且生成一種發射性的Ru- NR絡合物。光譜分析表明,Ru-FA可作為測定人體血清和小鼠器官中甲醛含量的探針,進而實現對活細胞溶酶體中甲醛的發光成像、腫瘤內源性甲醛的成像、小鼠體內甲醛清除過程的監測和對腫瘤及其他器官中甲醛的檢測。
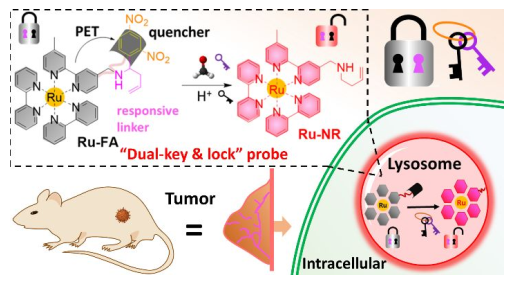
Liu, C.L., Zhang, R., Zhang, W.S., Yuan,J.L. et al. A “Dual-key-and-lock” Ruthenium Complex Probe for Lysosomal Formaldehydein Cancer Cells and Tumors. Journal of the American Chemical Society, 2019.
DOI: 10.1021/jacs.8b13898
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.8b13898
9. Nano Lett.:共遞送基于多肽的自噬基因和順鉑的系統用于改善化療耐藥性
順鉑化療是一種廣泛應用于多種癌癥的治療策略。然而,長期使用順鉑會造成耐藥性,這也嚴重阻礙了其治療效果和臨床轉化。其中,自噬誘導是腫瘤對順鉑產生耐藥性的常見原因之一。哈佛大學醫學院施進軍教授團隊、中山大學梅林教授團隊和國家納米科學中心王浩團隊合作研究了順鉑與RNAi協同自組裝納米前藥平臺對耐藥性肺癌的治療作用。該納米前藥平臺由鉑(IV)-多肽-雙(芘)前藥復合物、DSPE-PEG和cRGD修飾的DSPE-PEG等三個分子模塊組成。鉑(IV)通過酰胺鍵與多肽段連接,負載效率>95%;在谷胱甘肽(GSH)存在下鉑(IV)可以快速轉變為活性鉑離子(Pt(II))。同時,該前藥復合物肽可以有效地將Beclin1 siRNA (自噬啟動因子)傳遞到細胞質,從而導致自噬抑制。而DSPE-PEG和cRGD修飾的DSPE-PEG分子則可以改善納米前藥平臺的生物相容性和細胞攝取。體內實驗結果也表明,該納米前藥平臺能顯著抑制異種移植的耐藥腫瘤的生長,在靜脈給藥后的抑制率高達84%。
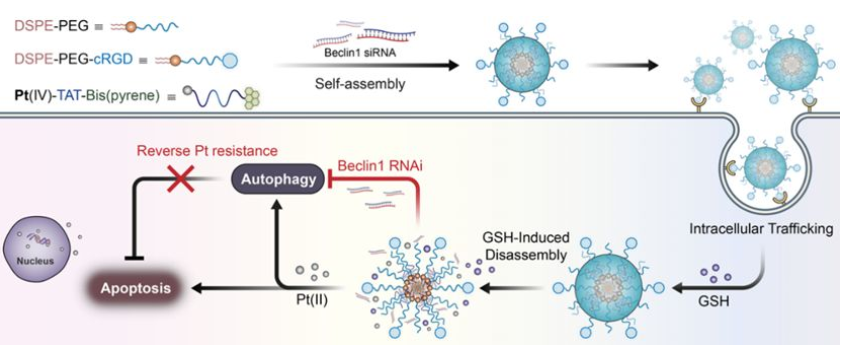
Lin, Y.X., Shi, J.J., Mei, L., Wang, H.et al. Peptide-based Autophagic Gene and Cisplatin Co delivery Systems Enable Improve Chemotherapy Resistance. Nano Letters, 2019.
DOI: 10.1021/acs.nanolett.9b00083
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00083
10. JACS:近紅外光控DNA納米器件用于對細胞和動物中的miRNA成像
納米器件具有作為檢測活細胞中miRNA的智能傳感系統的潛力。然而,始終處于活動狀態的納米器件往往不足以實現具有高時空分辨率的miRNA傳感。國家納米科學中心李樂樂研究員團隊利用DNA納米技術構建了一種可激活的DNA納米器件,該器件可用于在體內外檢測miRNA且具有較高的近紅外光控的時空精度。實驗通過在上轉換納米顆粒(UCNPs)的表面進行功能化,使其帶有DNA信標,從而構建了一種具有被紫外線激活的miRNA傳感性能的DNA納米器件。UCNPs可以吸收穿透深層組織的近紅外光,并在局部發射高能紫外光從而實現傳感。該納米器件也可以自然地進入細胞,因此可以通過遠程調節近紅外光使其對活細胞中的miRNA進行熒光成像。此外,實驗也證明該納米設備可以被用于在活體小鼠腫瘤內對miRNA進行成像。這一工作表明DNA納米器件在miRNA檢測方面具有實現高時空分辨率的潛力,這也將為精確的生物和醫學分析技術提供更多的技術支持。
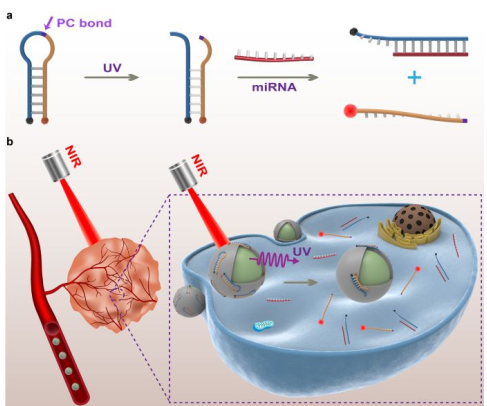
Zhao, J., Chu, H.Q. et al. A NIRLight-Gated DNA Nanodevice for Spatiotemporally Controlled Imaging of Micro RNAin Cells and Animals. Journalof the American Chemical Society, 2019.
DOI: 10.1021/jacs.9b01931
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.9b01931
11. ACS Nano:仿葡萄籽的智能水凝膠支架用于黑色素瘤治療和傷口愈合
葡萄籽提取物中含有豐富的黃酮類化合物和低聚原花青素(OPC)。受此啟發,中國科學院上海硅酸鹽研究所吳成鐵團隊將含有OPC的水凝膠支架作為治療黑色素瘤的天然光熱試劑和用于創面愈合的生物活性材料。這種水凝膠支架的流變特性可以對近紅外(NIR)激光照射的功率密度、輻照時間和OPC含量做出響應。而不同的輻照時間也對水凝膠支架的壓縮力學性能有一定的調節作用。在近紅外激光照射下,含OPC的水凝膠支架可以誘導產生可控高溫進而有效地殺滅黑色素瘤細胞,抑制腫瘤生長。此外,含有OPC水凝膠支架也可以支持人真皮成纖維細胞(HDFs)和人臍靜脈內皮細胞(HUVECs)的增殖和遷移,并在慢性傷口中明顯促進血管生成和皮膚再生。這一研究開發的含OPC的水凝膠支架在近紅外激光刺激下具有可控的光熱、流變和壓縮力學性能,對黑色素瘤治療和創傷愈合具有良好的生物活性。
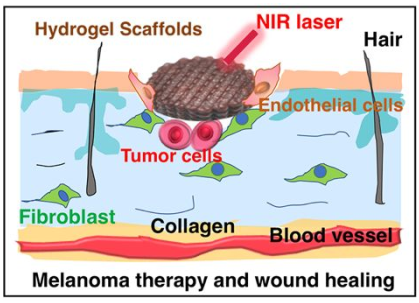
Ma, H.S., Wu, C.T. et al. Grape Seeds-Inspired Smart Hydrogel Scaffolds for Melanoma Therapy and Wound Healing. ACS Nano, 2019.
DOI: 10.1021/acsnano.8b09496
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.8b09496
12. Small:細胞膜偽裝的納米“三明治”結合光敏劑用于化學-光熱聯合治療
許多抗癌藥物都存在固有的疏水性,這給其臨床應用帶來了障礙。中國科學院過程工程研究所魏煒團隊和馬光輝團隊合作提出了一種基于納米晶體的仿生三明治結構。實驗以疏水藥物羥基喜樹堿(HCPT)為核心,利用血清白蛋白模板效應和溫和的納米沉淀法合成了具有高藥物負載效率的片狀納米晶(NCs)。同時,利用大量膜蛋白組成的偽裝癌細胞膜(CM)的包裹偽裝使得NCs在腫瘤部位具有同型靶向能力。而夾在NCs和CM之間的吲哚菁綠光敏劑不僅可以利用近紅外光進行光熱治療,還可以提高化療藥物的溶出度從而改善化療的效果。結果表明該平臺可以有效實現化學-光熱聯合治療,完全抑制腫瘤生長,且副作用少,因此有望成為利用疏水藥物進行癌癥治療的一種新方式。
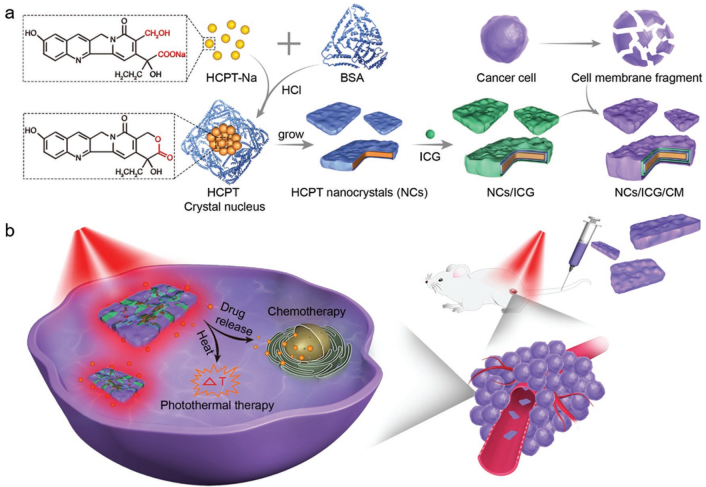
Zhang, L.J., Wei, W., Ma, G.H. et al. CellMembrane Camou?agedHydrophobic Drug Nanoflake Sandwiched with Photosensitizer forOrchestration of Chemo-Photothermal Combination Therapy. Small, 2019.
DOI: 10.1002/smll.201805544
https://doi.org/10.1002/smll.201805544
13. AFM:納米酶-水凝膠平臺用于捕獲和消除細菌
濫用抗生素會導致細菌產生多重耐藥性,這也促使研究人員去探索治療細菌感染的新方法。而納米酶的出現則為對抗細菌提供了新的策略。納米酶可以模擬天然酶的功能,誘導產生具有抗菌作用的高毒性活性氧(ROS)。但是納米酶與細菌之間往往缺乏有效的相互作用,而且活性氧的壽命短和擴散距離差等缺點也大大降低了其殺菌的活性。而長期留在感染區域的死細菌也會引起組織炎癥。中科院長春應化所任勁松研究員和曲曉剛研究員團隊首次構建了一種納米酶-水凝膠平臺來作為抗菌藥物。這種具有正電荷和大孔特性的納米酶-水凝膠能夠產生ROS從而消滅細菌。更重要的是,納米酶-水凝膠還可以消除細菌,從而大大降低后續產生炎癥的風險。
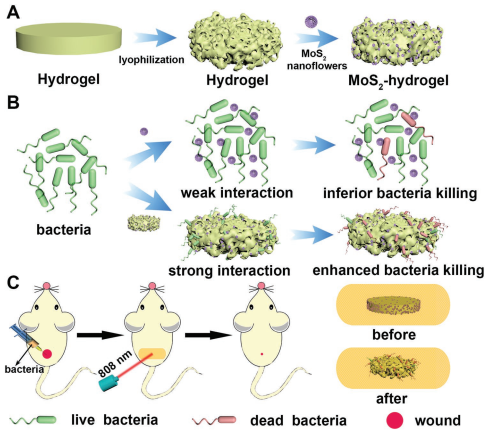
Sang, Y.J., Ren, J.S., Qu, X.G. et al.Construction of Nanozyme-Hydrogel for Enhanced Capture and Elimination of Bacteria. Advanced Functional Materials, 2019.
DOI: 10.1002/adfm.201900518
https://doi.org/10.1002/adfm.201900518
14. Adv. Sci.:各向異性等離子體金屬異質結構作為診療納米平臺
開發可同時進行近紅外(NIR)熒光成像和光學治療的診療平臺具有重要意義。中科院長春應化所張海元研究員團隊制備了一種各向異性等離子體金屬異質結構,即兩端沉積鉑的金納米棒(PEA NRs),其在808納米激光輻照下可以有效地產生熱電子,這些熱電子會通過電子-聲子弛豫釋放熱量,隨后通過化學轉化形成活性氧,因此具有良好的光熱和光動力性能。同時,PEANRs的電磁場也可以將能量轉移到鄰近的聚乙二醇(PEG)連接的近紅外熒光團(CF)上,從而顯著地放大CF-PEA NRs的近紅外熒光。實驗進一步將i-motif DNA / Nrf2 siRNA嵌合體與其相連接得到CF5k-bPEA@siRNANRs,發現可以其有效抑制細胞的抗氧化防御和耐高熱效應,具有很好的近紅外熒光成像和808納米激光激活的光熱-光動力治療能力,體內效果也十分顯著。
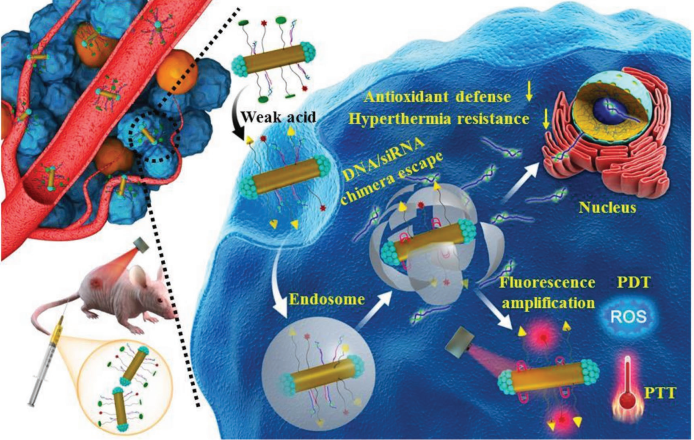
Chang, Y., Zhang, H.Y. et al. AnisotropicPlasmonic Metal Heterostructures as Theranostic Nanosystems for Near InfraredLight-Activated Fluorescence Amplifcation and Phototherapy. Advanced Science, 2019.
DOI: 10.1002/advs.201900158
https://doi.org/10.1002/advs.201900158
15. JACS:砷鉑-1是一種具有雙藥效團的抗癌藥物
砷鉑是兩種重要的抗癌藥物(順鉑和三氧化二砷)的加合物。而作為砷鉑-1 (AP- 1) 抗癌藥物的代表,[Pt(-NHC (CH3)O)2ClAs(OH)2]在大多數癌細胞株中都表現出優于親本藥物As2O3或順鉑的活性。美國西北大學Thomas V. O’Halloran教授團隊和意大利那不勒斯菲里德里克第二大學AntonelloMerlino團隊合作評估了AP-1與兩類重要的生物分子(蛋白質和DNA)的相互作用。結果表明,AP-1可以由鉑(II)與Nε結合的方式與模型蛋白質相連,從而保護其自身的Pt-As鍵。而AP-1也很容易進入細胞并進而以Pt-As鍵與DNA結合。而在孵育較長時間后,DNA中的Pt:As比例增加,這表明Pt-As鍵會發生斷裂并釋放As(OH)2。這一工作表明,砷鉑-1砷鉑-1是一種具有雙藥效團的抗癌藥物,可以用于對抗各種血液和實體癌癥。
Miodragovi?, ?., Merlino, A., O’Halloran, T.V. et al. Arsenoplatin-1is a Dual Pharmacophore Anti-Cancer Agent. Journalof the American Chemical Society, 2019.
DOI: 10.1021/jacs.8b13681
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.8b13681
16. AM綜述:二維粘土納米材料的生物醫學應用
粘土納米材料是一種新興的二維生物材料,由于其具有的原子薄層結構、帶電特性和良好的結構組成而備受研究人員的關注。納米粘土材料也具有良好的生物相容性、獨特的形狀、高的比表面積和電荷,因此也被廣泛應用于生物醫學領域。德州農工大學Akhilesh K. Gaharwar團隊對納米粘土材料與生物分子(包括細胞、蛋白質和聚合物)的物理、化學和生理相互作用進行了綜述;介紹了二維粘土材料納米在再生醫學、遞送治療性物質和生物制造方面的最新應用;也討論了這一新興領域未來的研究方向和面臨的挑戰。

Gaharwar, A.K., Cross, L.M. et al. 2DNanoclay for Biomedical Applications: Regenerative Medicine, TherapeuticDelivery, and Additive Manufacturing. Advanced Materials, 2019.
DOI: 10.1002/adma.201900332
https://doi.org/10.1002/adma.201900332
17. ACS Cent.Sci.:工程化磁小體可作為高性能的癌癥疫苗
北京理工大學謝海燕教授團隊和中科院過程工程研究所魏煒團隊合作,以Fe3O4磁性納米團簇(MNCs)作為核心,以抗CD205修飾的癌細胞膜作為偽裝的外衣制備了一種新型的癌癥疫苗。由于MNCs具有超順磁性和磁化作用,實驗可以實現疫苗在淋巴結內的磁滯留,從而為樹突狀細胞(DCs)攝取抗原提供了時間。而其表面修飾的癌細胞膜可存蓄各種抗原,隨后產生多抗原反應。此外,修飾的抗CD205也可以直接將更多的疫苗導入CD8+ DC,進而促進主要組織相容性復合體(MHC) I的交叉表達。這些獨特的性能使得該疫苗可以實現T細胞的大量增殖,具有優越的克隆多樣性和細胞毒性活性。實驗也在五種不同的腫瘤模型上觀察到有效的預防和治療效果。
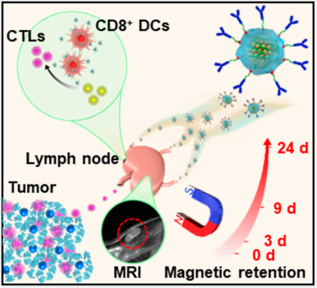
Li, F., Wei, W., Xie, H.Y. et al. EngineeringMagnetosomes for High-Performance Cancer Vaccination. ACS Central Science, 2019.
DOI: 10.1021/acscentsci.9b00060
https://pubs.acs.org.ccindex.cn/doi/10.1021/acscentsci.9b00060
18. Nature Biomed. Eng.:納米傳感器可通過分析尿液檢測早期的免疫排斥反應
芝加哥大學Anita S. Chong介紹了一種基于納米顆粒的傳感器系統,它可以通過檢測蛋白酶顆粒酶B的活性,從而對早期T細胞介導的免疫排斥反應進行分析。實驗在移植了皮膚的小鼠模型上進行了對傳感器效果評價,證明該系統可以通過檢測尿液中的熒光信號來分析排斥反應,而這種熒光信號是由免疫排斥反應誘導產生的蛋白酶顆粒酶B的水解作用生成再進入尿液中的。
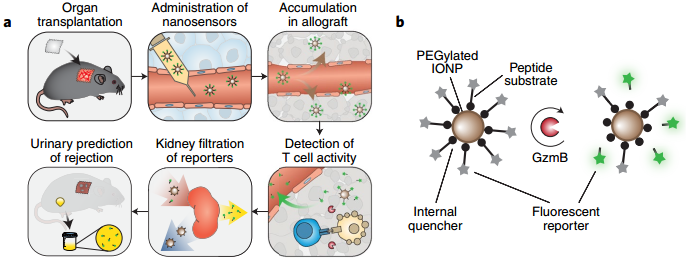
Chong, A.S. Urinary nanosensors of earlytransplant rejection. Nature Biomedical Engineering, 2019.
https://doi.org/10.1038/s41551-019-0389-0
19. Nature Biomed. Eng.:高靶向性納米藥物用于癌癥治療
新南威爾士大學MariaKavallaris團隊設計了一種包覆了對pH敏感的紫杉烷前藥和表面抗體修飾的納米顆粒MM-310,這種納米藥物可以靶向腫瘤中過表達的受體EphA2,從而大大提高了活性藥物在多種動物模型中的耐受性和抗癌效率。實驗結果表明,MM-310在多種腫瘤小鼠模型中具有非常顯著的治療效果,這也為未來研究靶向EphA2的納米治療藥物治療臨床實體腫瘤的應用奠定了良好的基礎。
Moles, E., Kavallaris, M. A potenttargeted cancer nanotherapeutic. Nature Biomedical Engineering, 2019.
https://doi.org/10.1038/s41551-019-0390-7
20. AM綜述:等離子體-納米孔生物傳感器用于單分子檢測
等離子體傳感器和納米孔傳感器在單分子檢測領域受到了人們的廣泛關注。等離子體傳感器能夠在納米尺度上增強光激發作用,進而實現對表面分析物之間相互作用的光學檢測。而納米孔生物傳感器則可具有分析物可穿過的分子尺度孔徑,再隨后通過電子或光學手段對其進行檢測。最近,等離子體和納米孔結構也已經被集成到單塊器件中,作用不僅解決了單個傳感方法各自的缺陷,也在改進檢測靈敏度、檢出率、停留時間和可伸縮性方面提供了很好的幫助。以色列理工學院Amit Meller教授團隊綜述了等離子體和納米孔傳感器的傳感原理,重點介紹了它們在技術方面的互補性和提高單分子傳感的性能的機理;介紹了近年來對等離子體-納米孔器件的研究進展和等離子體-納米孔器件的常見制備方法,并對其未來發展方向和應用領域進行了展望。
Spitzberg, J.D., Meller, A. et al. Plasmonic-NanoporeBiosensors for Superior Single-Molecule Detection. Advanced Materials, 2019.
DOI: 10.1002/adma.201900422
https://doi.org/10.1002/adma.201900422
21. Angew:近紅外光刺激外源性酶指導前藥的轉化用于局部化學-光熱聯合治療
酶在癌癥治療中主要用于指導前藥的轉化。然而,內源酶在體內的非特異性分布嚴重阻礙了其生物應用。北京化工大學劉惠玉教授團隊和袁其朋教授團隊合作設計了一種基于外源性酶遞送和重建腫瘤微環境的策略,進而實現近紅外光觸發的局部化學-光熱聯合治療。光熱治療可以提高酶轉化前藥的催化效率,而化療則也會抑制熱休克蛋白90從而提高光熱療法(PTT)的治療效果。這種局部化學-光熱治療策略在4T1荷瘤小鼠模型中獲得顯著的治愈效果。這種利用近紅外光去啟動PTT與化療之間的相互強化回路的策略也在癌癥治療領域具有廣闊的應用前景。
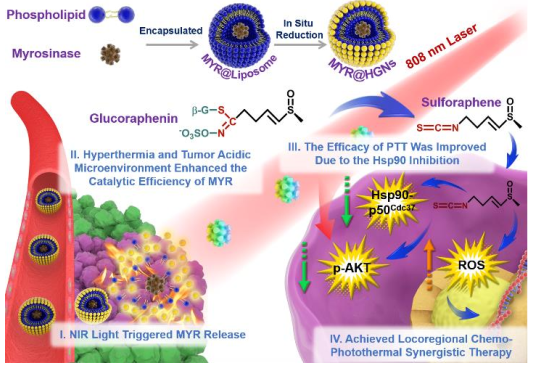
Cheng, L., Zhang, F.R., Liu, H.Y., Yuan,Q.P. et al. NIR-Triggered Exogenous Enzymes to Convert Prodrugs for LocoregionalChemo-Photothermal Therapy. Angewandte Chemie International Edition, 2019.
DOI: 10.1002/anie.201902476
http://dx.doi.org/10.1002/anie.201902476
22. AFM綜述:微發光二極管的生物醫學應用
基于無機材料的微發光二極管(μLED)將改變未來光電系統的傳統模式,其在生物醫學領域也具有很好的應用價值。μLED顯示屏不僅可以成為視覺通信的大型界面平臺,也可以擴展到物聯網和可穿戴的生物應用領域。同時,μLED也需要不斷升級才能滿足其今后的光電應用需求,如用于虛擬現實、構建智能手表和醫療傳感器等等。韓國科學技術高級研究院Keon Jae Lee團隊從器件結構、實現大規模LED傳輸、提高性能方法和未來的應用等方面對μLED領域的代表性進展進行了詳細的綜述。
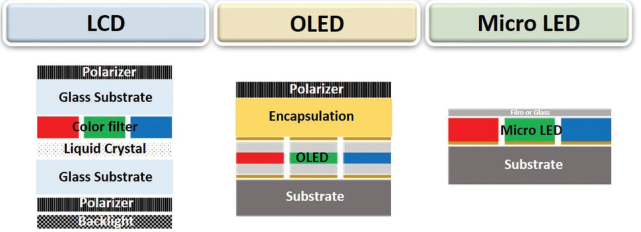
Lee, H.E., Lee, K.J.et al. Micro Light-Emitting Diodes for Display and Flexible BiomedicalApplications. Advanced Functional Materials, 2019.
DOI: 10.1002/adfm.201808075
https://doi.org/10.1002/adfm.201808075











