1. ACS Nano:氧化還原激活和酸增強的診療平臺用于近紅外II區光聲成像和光熱治療
近紅外II區(NIR-II, 1000-1700 nm)腫瘤光學診療具有較高的時空精度、穿透深度和治療效果,因此應用前景廣闊。而非特異性診斷和治療引起的不良副作用也一直影響NIR-II區光學診療藥物進一步的應用。新加坡南洋理工大學浦侃裔教授團隊和邢本剛教授團隊合作,制備了一種生物相容性高的納米診療試劑。它只有在腫瘤微環境內的氧化還原激活和酸增強下才能產生診斷和治療效果,而在正常組織中則沒有作用。這種智能的納米診療平臺可以在NIR-II區范圍內實現活體零背景的光聲成像(PAT)和腫瘤光熱治療(PTT),并且副作用極低,具有廣闊的臨床應用前景。
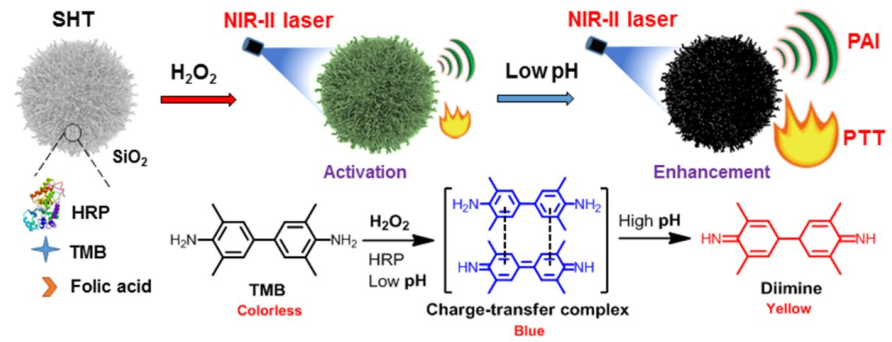
Zhimin Wang, Kanyi Pu, Bengang Xing. et al. Redox-Activatable and Acid-Enhanced Nanotheranostics for Second Near-Infrared Photoacoustic Tomography and Combined Photothermal Tumor Therapy. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01411
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b01411
2. 鄭州大學Nano Lett.:連續胞內納米遞送系統用于增強ROS誘導的抗腫瘤治療
盡管近年來人們在提高光動力治療(PDT)的療效方面取得了一些進展,但是要想實現基于活性氧(ROS)的高效治療,尤其是在治療惡性腫瘤方面仍然具有很大的挑戰性。緩解腫瘤組織的乏氧被認為是提高ROS治療效果的一個有效策略。然而,乏氧區域通常位于腫瘤的深部而難以進入,而這一點常常被人們所忽視。鄭州大學張紅嶺團隊和張振中團隊合作構建了一種連續的細胞內遞送系統(MFLs/LAOOH@DOX),該系統由膜融合脂質體(MFLs)和包埋在脂質雙層膜中的亞油酸過氧化氫(LAOOH)組成。實驗選擇體內脂質過氧化的主要產物之一LAOOH作為ROS生成劑,它是依賴于Fe2+而非氧氣或外界刺激產生ROS的。得益于EPR效應,MFLs/LAOOH@DOX可首先與血管周圍腫瘤細胞膜同步融合,并選擇性地將LAOOH遞送至質膜,并在細胞內按需釋放DOX。而LAOOH作為細胞膜的天然成分,可通過細胞外囊泡來逐漸蔓延到鄰近細胞,并最終擴散到整個腫瘤。隨后,通過給藥納米Fe3O4,LAOOH可特異性地在腫瘤細胞膜上產生ROS。這一研究也為提高基于ROS的抗腫瘤治療的效率提供了一種新的方法。
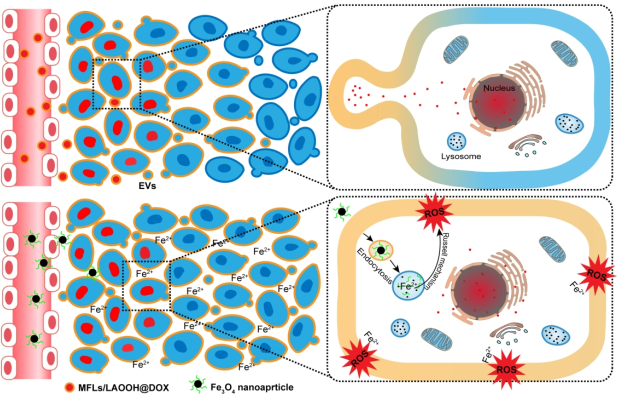
binghua Wang, Hongling Zhang, Zhenzhong Zhang. et al. Sequential Intercellular Delivery Nanosystem for Enhancing ROS-induced Anti-tumor Therapy. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00336
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00336
3. 哈佛醫學院Small綜述:3D生物打印的轉化應用
在過去的幾十年里,構建3D生物組織在組織工程和再生醫學中已經變得很普遍。然而,傳統的3D生物制造技術在制造復雜組織結構方面能力有限,無法達到復制生物相關組織所需的精度和可控性的要求。而3D生物打印技術則為制造結構和功能相關的仿生體組織提供了強有力的幫助。它能夠精確地控制結構的組成、空間分布和架構,從而幫助再現目標器官和組織的精細形狀和結構。哈佛醫學院Yu Shrike Zhang團隊系統地介紹了3D生物打印技術的發展歷史以及近年來的最新研究進展;隨后討論了3D生物打印技術的未來發展方向,如實現高分辨率、多種材料和4D生物打印等方面;最后介紹了3D生物打印技術的臨床轉化潛力,并以商業上可用的生物打印平臺為例進行了詳細介紹。
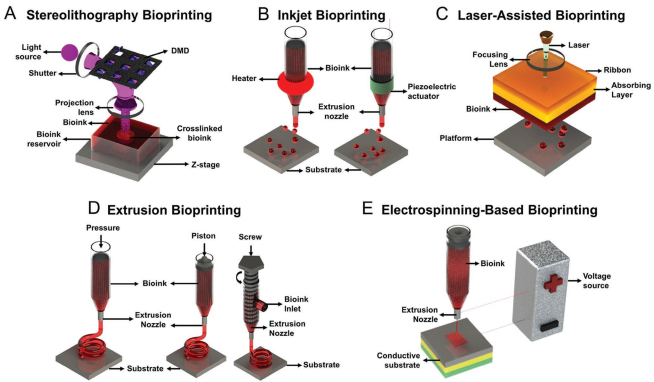
Marcel Alexander Heinrich, Yu Shrike Zhang. et al. 3D Bioprinting: from Benches to Translational Applications. Small. 2019
DOI: 10.1002/smll.201805510
https://doi.org/10.1002/smll.201805510
4. Angew:卟啉納米籠組成的單分子納米顆粒用于腫瘤診療
單分子納米粒子(SMNPs)可將成像和治療功能集合于一體,具有良好的生物相容性、高穩定性、更長的血液循環半衰期和較好的腫瘤積累等優點,在腫瘤診療領域具有十分突出的優勢。美國國立衛生研究院陳小元團隊和杭州師范大學李世軍團隊合作制備了一種復雜的卟啉納米材料,同時對該材料進行了進一步的功能化來制備SMNPs (porSMNPs),并將其作為腫瘤診療平臺。正電子發射層析成像證明了該porSMNPs具有良好的血液循環時長和在腫瘤部位的積累效率,這可歸因于porSMNPs所具有的良好EPR效應。此外,其具有的籠形結構也可通過抑制π-π堆積相互作用來顯著地提高porSMNPs的光敏劑性能,實現高效無復發的腫瘤光動力治療。
Guocan Yu, Tian-Yong Cen, Zhimei He, Shijun Li, Sheng Wang, Xiaoyuan Chen. et al. Porphyrin Nanocage-Embedded Single Molecular Nanoparticle as Cancer Nanotheranostics. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201903277
http://dx.doi.org/10.1002/anie.201903277
5. 北京化工大學AFM:靈活透氣的納米網膜電子設備用于按需治療
柔性電子技術在可穿戴醫療、生物監護、隨需應變治療和人機交互等方面具有廣闊的應用前景。然而,傳統的塑料基板具有不舒適、機械不匹配和不透氣的缺點,這也大大限制了柔性電子設備的應用價值。北京化工大學萬鵬博教授團隊和張立群教授團隊設計了一種具有實時溫度傳感功能的柔性透氣電子設備,該設備也能夠在傷口部位進行及時的抗感染治療。該器件是由負載有鹽酸莫西沙星(MOX)的熱響應聚合物交聯的納米網膜組裝而成。該導電聚合物納米網膜具有良好的柔韌性、透氣性和環境穩定性。此外,其具有的溫度傳感性能可通過電阻與溫度之間的線性關系來對傷口部位的組織溫度進行實時監測,也可與無線發射機進行耦合以實現實時無線溫度監測。同時,該納米網膜也可被組裝成高效的柔性加熱器,以觸發對負載的抗生素實現按需釋放,從而在感染發生后消除傷口部位的細菌。
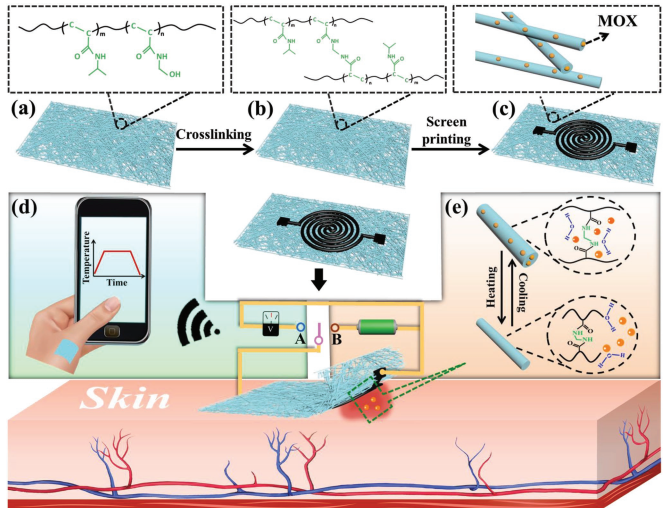
Min Gong, Pengbo Wan, Liqun Zhang. et al. Flexible Breathable Nanomesh Electronic Devices for On-Demand Therapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201902127
https://doi.org/10.1002/adfm.201902127
6. 慕尼黑大學Chem. Mater.:介孔二氧化硅納米顆粒作為可降解的藥物載體
將介孔二氧化硅納米顆粒(MSNs)作為分子藥物遞送載體具有很好的應用價值。然而,想要將MSNs進一步轉化為臨床應用卻仍然困難重重,其中的一個突出難題就是實現這些納米顆粒在體內的降解。具有可降解性的藥物載體可以在生物系統中進行應用時避免潛在的危險影響,也可以通過有效釋放藥物來提高治療效果。然而到目前為止,關于MSNs的水解或生物降解性的研究還很有限。慕尼黑大學Karin M?ller團隊和Thomas Bein團隊合作,對多種不同的MSNs在生物醫學相關條件下的降解性進行了綜合評價。實驗在酸性、中性和堿性等不同條件下合成了MSNs,并采用電感耦合等離子體發射光譜法(ICP)、透射電鏡(TEM)、紫外-可見光譜(UV-VIS)和紅外光譜(FTIR)等手段對降解過程進行了定量評價。結果發現在低顆粒濃度下,MSNs的溶解速率主要受二氧化硅內部網絡的連通性和構建模塊影響。由此證明介孔二氧化硅納米顆粒的降解性可以被充分調控,以滿足其在不同靶向藥物遞送應用中的需求。
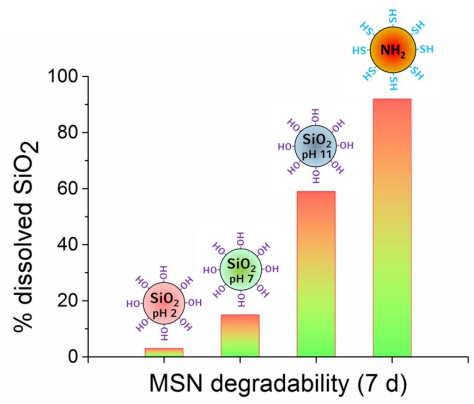
Karin M?ller, Thomas Bein. Degradable Drug Carriers: Vanishing Mesoporous Silica Nanoparticles. Chemistry of Materials. 2019
DOI: 10.1021/acs.chemmater.9b00221
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.chemmater.9b00221
7. Nature Commun.:肝靶向納米技術助力黃連素治療心血管代謝疾病
心血管代謝疾病(CMD)是造成人類過早死亡的主要原因。黃連素(BBR)是一種可以降脂的植物化合物,具有多種抗代謝紊亂的作用,因此有望治療CMD相關疾病。而肝臟則是BBR的靶點部位,實現BBR在肝臟部位的有效積累對于治療效果的改善將大有裨益具。中國醫學科學院北京協和醫學院王璐璐團隊、鄭穩生團隊、韓燕星團隊和蔣建東團隊合作,設計了由疏水的α-生育酚內核及聚乙烯乙二醇-硫醇外殼組成的膠束(CTA-Mic)并將其用于實現BBR的肝臟靶向。生物分布結果表明,該膠束可以使得BBR在肝臟積累量增加248.8%,并且在HepG2細胞內和體內可以檢測到一系列與能量代謝相關的基因上調。實驗在高脂飲食喂養的小鼠中發現,BBR-CTA-Mic可顯著改善代謝狀況,減少主動脈弓斑塊的形成。這一研究結果為利用納米技術改善天然藥物治療CMD的效果提供了新的策略。
Hui-Hui Guo, Lu-Lu Wang, Wen-Sheng Zheng, Yan-Xing Han, Jian-Dong Jiang. et al. Liver-target nanotechnology facilitates berberine to ameliorate cardio-metabolic diseases. Nature Communications. 2019
https://doi.org/10.1038/s41467-019-09852-0
8. Nature Commun.:檢查點阻斷和納米增敏劑用于增強聲動力治療并降低腫瘤轉移
將檢查點阻斷(如PD1/PD-L1)與傳統臨床治療相結合往往產生副作用和較低的腫瘤治療效果。同濟大學張坤團隊、徐輝雄團隊和中國科學院上海硅酸鹽研究所陳雨團隊合作報告了一種利用納米增敏劑去增強聲動力治療(SDT)并將其和檢查點阻斷免疫治療相結合的腫瘤治療模式。實驗使用的納米增敏劑(HMME/R837@lip)的所有成分均已獲得臨床批準。其中,作為載體的脂質體將聲敏劑(血卟啉單甲醚(HMME))和免疫佐劑(亞米喹莫特(R837))進行共同包裹。實驗利用多個腫瘤模型證明了這種增強的SDT與抗PD-L1結合后可以誘導抗腫瘤反應,不僅可以阻止原發性腫瘤的生長,還可以防止其向肺部轉移。該聯合治療策略還可提供長期的免疫記憶功能,以防止腫瘤的復發。
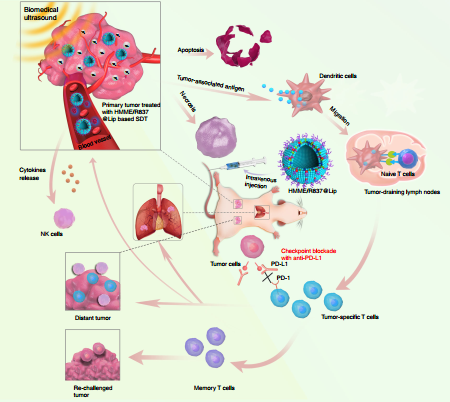
Wenwen Yue, Kun Zhang, Huixiong Xu, Yu Chen. et al. Checkpoint blockade and nanosonosensitizeraugmented noninvasive sonodynamic therapy combination reduces tumour growth and metastases in mice. Nature Communications. 2019
https://doi.org/10.1038/s41467-019-09760-3
9. Adv. Sci.:低聚透明質酸包覆二氧化硅/羥基磷灰石納米顆粒用于靶向治療癌癥
靶向藥物遞送系統(TDDSs)可以實現特異性地腫瘤靶向和藥物釋放,為克服傳統化療的副作用提供了一種很好的方法。透明質酸(HA)作為一種可選擇性靶向CD44的藥物,在TDDSs研究中得到了廣泛的應用。然而,不同分子量的HA對CD44具有不同的結合能力,這也會產生不同的治療效果。大連理工大學樊江莉團隊和國家納米科學中心梁興杰團隊合作制備了一種負載了阿霉素(DOX)的二氧化硅/羥基磷灰石(MSNs/HAP)雜化材料(DOX@MSNs/HAP)。隨后。實驗將HA和低聚HA(oHA)分別包覆在雜化材料上構建了HA-DOX@MSNs/HAP和oHA-DOX@MSNs/HAP,并研究了它們各自的腫瘤靶向性。結果發現由于oHA對于靶向CD44更加有效,oHA-DOX@MSNs/HAP在腫瘤內具有更高的細胞吸收和藥物釋放效率,因此其抗癌作用也有顯著增強,荷瘤小鼠模型實驗也同樣證明了這一點。因此,該研究也為今后設計靶向腫瘤的化療納米藥物遞送系統提供了新的思路。
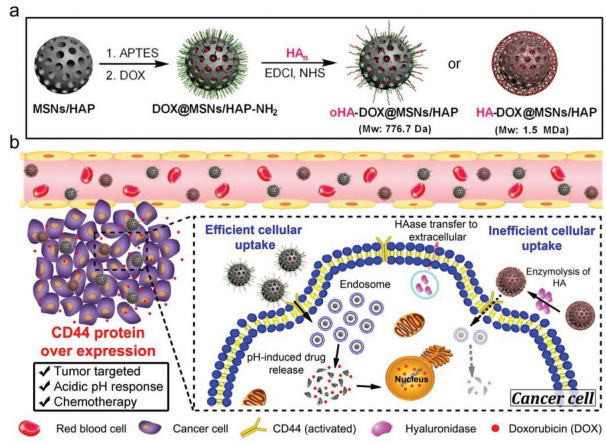
Yao Kang, Jiangli Fan, XingJie Liang, Xiaojun Peng. et al. Oligo Hyaluronan-Coated Silica/Hydroxyapatite Degradable Nanoparticles for Targeted Cancer Treatment. Advanced Science. 2019
DOI: 10.1002/advs.201900716
https://doi.org/10.1002/advs.201900716
10. AFM:Janus微載體用于磁場控制的肝癌聯合化療
利用多種化療藥物進行聯合化療在臨床上被廣泛應用于治療各種癌癥,特別是對于最常見的肝癌(HCC)來說,將抑制細胞生長的多激酶抑制劑和細胞毒性化療藥物進行聯合使用被認為是一種很有效的治療方法。美國西北大學Dong-Hyun Kim教授團隊和韓國科學技術院Shin-Hyun Kim團隊合作,利用Janus微載體來進行針對肝癌的局部控制聯合化療。這種Janus微載體由聚已酸內酯(PCL)和載有磁性納米顆粒的聚乳酸-羥基乙酸共聚物(PLGA)組成,其中含有疏水的瑞格拉非尼和親水的阿霉素兩種藥物。實驗發現,利用磁場可以控制Janus微載體進行旋轉運動,進而實現兩種化療藥物的主動共釋放。此外,這種Janus微載體也具有磁共振(MR)對比效應,可將負載的聯合化療藥物遞送至腫瘤部位。因此,該Janus微載體可作為一種通用的聯合化療平臺用于實現多種化療藥物的協同遞送。
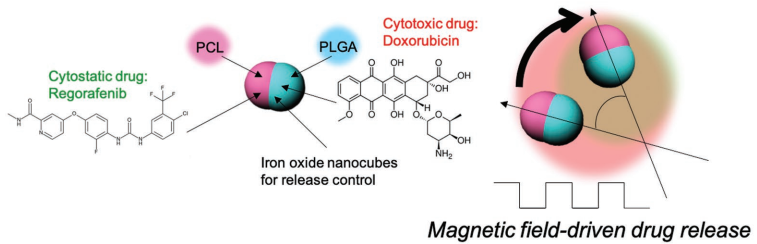
Soojeong Cho, Shin-Hyun Kim, Dong-Hyun Kim. et al. Janus Microcarriers for Magnetic Field-Controlled Combination Chemotherapy of Hepatocellular Carcinoma. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901384
https://doi.org/10.1002/adfm.201901384
11. AFM:具有廣譜金屬摻雜能力的超小量子點用于三模態分子成像
由于納米材料常常會在肝、脾等免疫組織中進行非特異性的積累,因此開發具有良好的特異性靶向功能的納米材料具有重要的意義。超小納米粒子(USNPs)在體內具有類似于小分子的藥代動力學特性,可以與其他功能材料進行整合以提高分子成像效率。例如在核醫學成像領域,可以利用多種策略放射性金屬引入USNPs的結構中。然而,這往往會改變UNSPs的表面性質和體內行為,也難免涉及到復雜的合成步驟。美國國立衛生研究院陳小元團隊和武漢大學崔然團隊合作報道了一種新的無螯合吸附廣譜金屬離子的策略。實驗制備的超小Ag2Se量子點(QDs)的表面有活性氧層,可以結合活性的或惰性的放射性金屬同位素,并具有很高的標記效率。由此制備的納米探針可以進行熒光、磁共振成像和PET三模態成像。在進一步與靶向肽結合后,該探針在PET成像中顯示出9倍的瘤肉信號比。并且可通過腎臟在12小時內排出體外。這一工作為探索廣譜的放射性金屬同位素標記和基于USNPs的成像探針開辟了一條新的道路。
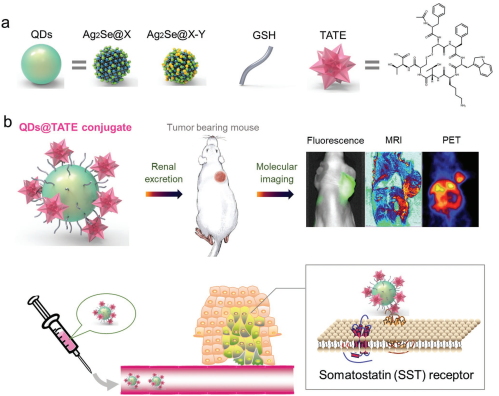
Rui Tian, Ran Cui, Shoujun Zhu, Xiaoyuan Chen. et al. Ultrasmall Quantum Dots with Broad-Spectrum Metal Doping Ability for Trimodal Molecular Imaging. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901671
https://doi.org/10.1002/adfm.201901671
12. Adv. Sci.:利用類似于亞硝基-二烯的生物正交反應進行光激活的熒光標記
熒光標記可以在低背景下對細胞內分子進行成像。中山大學蔣先興團隊和上海科技大學劉佳團隊合作介紹了一種高效的,基于亞硝基Diels Alder反應的生物正交熒光標記策略,并驗證了這種方法在用于活細胞標記和動態細胞成像中的有效性和可控性。實驗通過對蛋白質和活細胞進行紫外光(UV)激活的熒光標記,證明了亞硝基環加成是一種高效的熒光標記反應。通過UV照射可以對標記蛋白的熒光進行調節,進而可以在給定的時間點來選擇性地激活細胞內的特定蛋白,而不會對其余的標記分子造成影響。
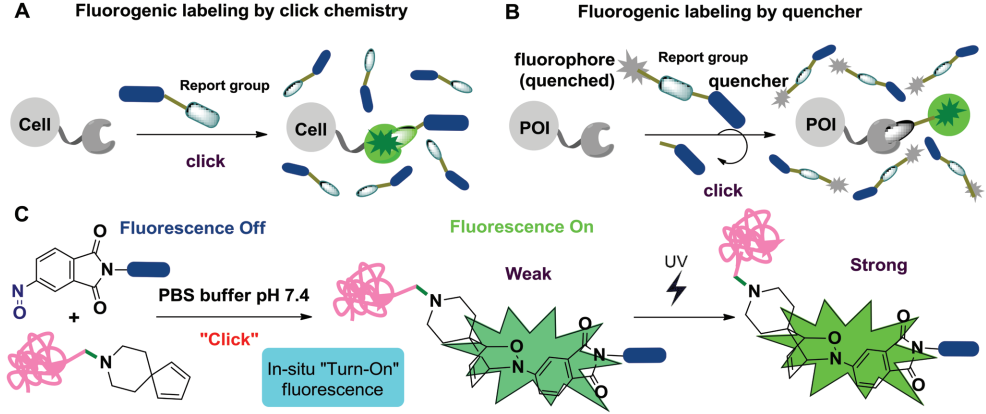
Bai Li, Jia Liu, Xianxing Jiang. et al. Photoactivatable Fluorogenic Labeling via Turn-On“Click-Like” Nitroso-Diene Bioorthogonal Reaction. Advanced Science. 2019
DOI: 10.1002/advs.201802039
https://doi.org/10.1002/advs.201802039
13. AFM:可生物降解的Fe(III)@WS2-PVP納米膠囊用于催化-光熱-化學聯合治療
上海理工大學王世革團隊和中國科學院上海硅酸鹽研究所陳航榕團隊合作制備了具有良好生物相容性的Fe(III)@WS2-PVP納米膠囊,其具有可生物降解和負載阿霉素(DOX)的能力。在該納米膠囊中,Fe(III)會與WS2發生氧化還原反應,形成Fe2+和WO42-。形成的Fe2+可再被氧化為Fe3+并與Fe(III)@WS2-PVP反應,繼續生成Fe2+和WO42-。這種重復的內源性氧化還原反應使得DOX@Fe(III)@WS2-PVP的生物降解性和DOX釋放能力增強。同時腫瘤內過表達的H2O2和輕度酸性的腫瘤微環境(TME)也會進一步促進Fe2+的生成和DOX的釋放。持續生成的Fe2+會與腫瘤細胞內固有的H2O2進行類芬頓反應,產生大量的高毒性羥基自由基用于腫瘤治療。同時,DOX@Fe(III)@WS2-PVP納米膠囊也具有較高的光熱轉化能力,可以成功地實現催化-光熱-化學聯合治療對抗腫瘤。
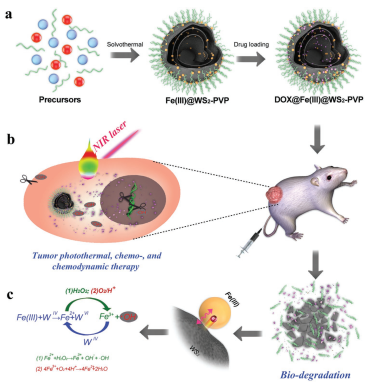
Chenyao Wu, Shige Wang, Hangrong Chen. Biodegradable Fe(III)@WS2-PVP Nanocapsules for Redox Reaction and TME-Enhanced Nanocatalytic, Photothermal, and Chemotherapy. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201901722
https://doi.org/10.1002/adfm.201901722
14. 韓亮AFM:納米顆粒通過跨細胞和細胞旁路途徑跨越血腦腫瘤屏障靶向腦轉移瘤
腦轉移瘤是一種最難以治療的惡性腫瘤,因為它的病灶位置多且生長快速。雖然化療為治療腦轉移瘤提供了一些希望,但是由于血腦腫瘤屏障(BTB)的存在,通過全身給藥的方式在治療腦轉移瘤時效果往往很差。蘇州大學韓亮團隊報道了負載米諾地爾的透明質酸納米粒子(M@H-NPs)可以通過跨細胞和細胞旁路途徑和透明質酸與CD44靶點的協同作用來有效地特異性越過BTB,靶向腦轉移瘤。實驗發現,M@H-NPs可以增強腦轉移瘤病灶中BTB內皮細胞的胞吞轉運作用以及下調緊密連接蛋白表達水平的能力,從而能夠促進其穿透BTB。因此,M@H-NPs可以選擇性地將阿霉素(DOX)遞送到腦轉移瘤病灶部位,同時不會傷害正常腦細胞。結果證明,通過M@H-NPs/DOX治療可顯著延長腦轉移瘤小鼠的生存期,因此這一研究也為臨床治療腦轉移瘤的提供了一種新的方法。
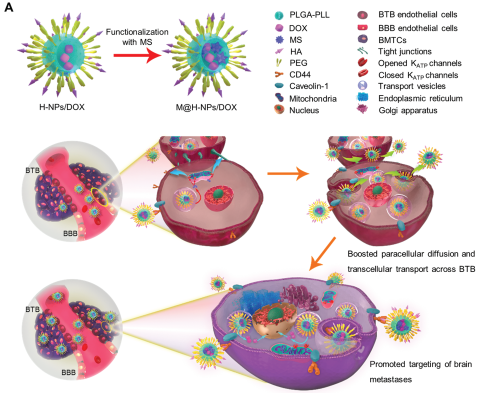
Tongtong Miao, Liang Han. et al. Nanoparticles Surmounting Blood–Brain Tumor Barrier Through Both Transcellular and Paracellular Pathways to Target Brain Metastases. Advanced Functional Materials. 2019
DOI: 10.1002/adfm.201900259
https://doi.org/10.1002/adfm.201900259
15. Angew:類過氧化氫酶MOF納米復合材料用于放射-化學協同治療
腫瘤乏氧是目前腫瘤治療的桎梏之一。南京大學朱俊杰團隊、美國國立衛生研究院陳小元團隊和澳門大學代云路團隊合作提出了一種利用卟啉MOF-金納米顆粒(AuNPs)復合材料作為原位催化氧化平臺進行腫瘤治療的策略,它可以實現放射-化學協同治療。修飾在MOF表面的AuNPs可有效穩定納米復合材料,并可作為放射增敏劑,而MOF則可用于包裹化療藥物阿霉素。體內外研究結果證實,該類過氧化氫酶MOF納米復合材料可以顯著提高放療效果,緩解腫瘤乏氧以達到協同抗癌效果,且全身毒性極低。
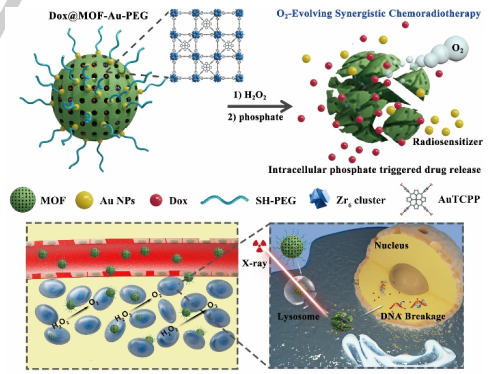
Zhimei He, Xiaolin Huang, Chen Wang, Jun-Jie Zhu, Guocan Yu, Yunlu Dai, Xiaoyuan Chen. et al. A Catalase-Like Metal-Organic Framework Nanohybrid for O2-Evolving Synergistic Chemoradiotherapy. Angewandte Chemie International Edition. 2019
DOI: 10.1002/anie.201902612
http://dx.doi.org/10.1002/anie.201902612
16. JACS:自組裝響應型雙層囊泡用于增強的癌癥成像和治療
福州大學楊黃浩團隊和美國國立衛生研究院陳小元團隊合作,將氧化鐵-金納米粒子(Fe3O4-Au JNPs)組裝成磁性-等離子體雙層囊泡用于活性氧(ROS)增強的腫瘤化療。計算結果和實驗數據證明了該雙層囊泡具有增強的光學性能。由于粒子間磁偶極子相互作用和等離激元耦合作用,該囊泡的T2馳豫率和光聲性能比單個JNPs都更強。在酸性腫瘤微環境中,對pH響應的囊泡可分解為單個JNPs,進而在細胞內進行PLHP和亞鐵離子的生化反應,產生活性氧來增加細胞內氧化應激。通過結合ROS的細胞毒性和DOX誘導的化療,該材料治療腫瘤的效果十分顯著。而利用放射性同位素64Cu對囊泡進行標記后則可利用PET成像證明其在腫瘤內的高效聚集和體內清除效率。

Jibin Song, Zhan-Wei Li, Huanghao Yang, Xiaoyuan Chen. et al. Self-Assembled Responsive Bilayered Vesicles with Adjustable Oxidative Stress for Enhanced Cancer Imaging and Therapy. Journal of the American Chemical Society. 2019
DOI: 10.1021/jacs.8b13902
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.8b13902
17. 張先正ACS Nano:多功能一氧化碳納米發生器用于增強腫瘤治療和抗炎
一氧化碳(CO)被認為是一種有效的治療試劑,它具有多種有益的生物醫學應用功能。武漢大學張先正團隊制備了一種用于腫瘤治療和抗炎的多功能CO納米發生器(PPOSD)。實驗在部分氧化的二硫化錫(SnS2)納米片(POS NSs)表面修飾了靶向聚合物(PEG-cRGD),然后進一步負載化療藥物阿霉素(DOX)制備了PPOSD。經靜脈注射后,該材料通過cRGD介導的腫瘤識別可選擇性地在腫瘤組織中積累。在561 nm激光照射下,PPOSD中的POS基團可以將CO2還原為CO,使DOX的化療效果顯著敏化。此外,PPOSD中的POS還可以作為一種光熱試劑,在808 nm激光照射下對腫瘤進行有效的光熱治療(PTT)。此外,生成的CO可有效降低PTT引起的炎癥反應,且在治療后不會引起明顯的全身毒性反應,說明PPOSD也具有良好的生物安全性。

Shi-Bo Wang, Cheng Zhang, Xian-Zheng Zhang. et al. A Versatile Carbon Monoxide Nanogenerator for Enhanced Tumor Therapy and Anti-Inflammation. ACS Nano. 2019
DOI: 10.1021/acsnano.9b00345
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b00345
18. 王富安ACS Nano:可自我分解代謝的DNA酶納米海綿用于智能遞送抗癌藥物
自組裝DNA納米藥物的開發需要一種簡便準確的DNA降解策略來精確地實現藥物釋放。傳統的DNA分解代謝方法受到酶促反應的限制,導致DNA的分解代謝效率低下、且無法控制,從而不利于在復雜的生物系統中進行應用。武漢大學王富安團隊報告了一個多功能的DNA酶驅動的藥物遞送系統,它包括聚合的DNA酶底物支架和被封裝的對pH響應的ZnO納米顆粒(NPs)。該DNA酶納米海綿(NSs)也被編碼了多價串聯適配體序列,以高效地將其遞送到癌細胞中。在酸性的溶酶體微環境下,ZnO會溶解產生Zn2+離子,它可作為DNA酶的輔助因子和治療性ROS的產生者。Zn2+輔助因子可以介導DNA支架的酶催化裂解,進而實現精確高效地給藥,增強治療效果。
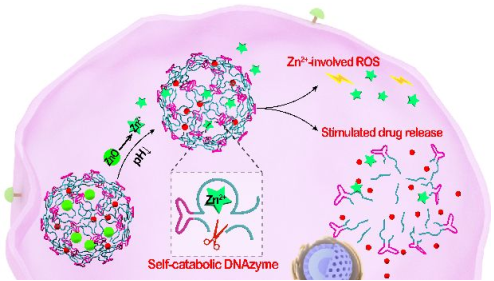
Jing Wang, Fuan Wang. et al. Nonviolent Self-Catabolic DNAzyme Nanosponges for Smart Anticancer Drug Delivery. ACS Nano. 2019
DOI: 10.1021/acsnano.9b01589
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.9b01589
19. Nature Rev. Mater.:用于淋巴結給藥的材料
人體免疫細胞中有很大一部分位于淋巴結中。在這些淋巴結內,淋巴細胞會聚集、活化和進行增殖。淋巴結靶向技術為直接向淋巴細胞和淋巴結駐留細胞遞送藥物進而改變適應性免疫反應提供了幫助。然而,目前還很難將游離的藥物遞送到特定的淋巴細胞群中。因此需要開發可以作為載體的材料,以幫助實現藥物在淋巴結內的積累,并靶向特定的淋巴結駐留細胞亞型。喬治亞理工學院Susan N. Thomas團隊對淋巴結的分隔結構以及細胞和液體在淋巴結之間的轉運機制進行了綜述介紹,討論了材料進入淋巴結的不同途徑以及對它們的藥物遞送過程,包括由淋巴管,血液毛細血管,高內皮靜脈,細胞介導的途徑等等;介紹了不同的,靶向特定的免疫細胞的微納米尺度材料并強調了它們在治療免疫功能障礙疾病和癌癥的免疫治療中的應用潛力;最后也對該領域的前景進行了展望。
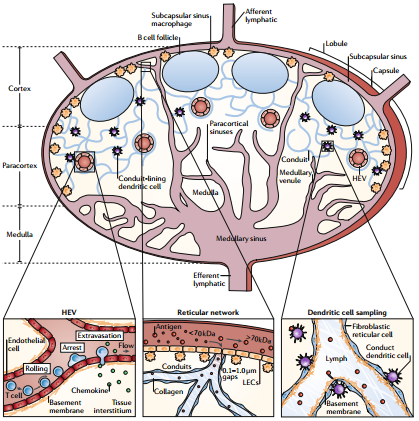
Alex Schudel, Susan N. Thomas. et al. Material design for lymph node drug delivery. Nature Reviews Materials. 2019
https://doi.org/10.1038/s41578-019-0110-7
20. 戴志飛ACS Nano:基于生物發光和熒光共振能量轉移的納米氣泡超聲造影劑用于炎癥成像
炎癥是一種免疫反應,包括神經退行性疾病和癌癥等各種炎癥性疾病。利用魯米諾試劑可檢測炎癥區域內過氧化物酶(MPO)活性。然而,這種方法往外組織穿透率低且空間分辨率差。北京大學戴志飛團隊通過將生物發光共振能量轉移(BRET)和熒光共振能量轉移(FRET)相結合,制備了一種摻雜了兩種親脂染料的納米氣泡(NB)。實驗在脂多糖誘導的炎癥模型中證明了這種BRET-FRET策略能夠使得可被檢測的發射光增加24倍。此外,BRET-FRET NBs也可以利用高空間分辨率的超聲成像對灌注后的組織微血管進行成像。與市場上的超聲造影劑相比,BRET-FRET NBs具有更強的對比度增強能力。研究利用該生物熒光/超聲雙模態造影劑對乳腺癌動物模型進行了成功的顯像,且具有很好的生物安全性。這一研究通過結合生物發光成像和超聲成像的優點,有望解決炎癥成像面臨的諸多難題。
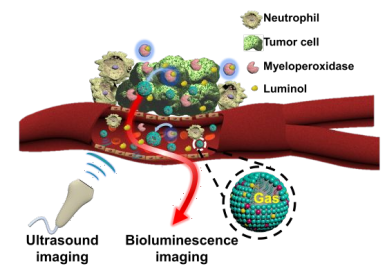
Renfa Liu, Jie Tang, Zhifei Dai. Bioluminescence Imaging of Inflammation in Vivo Based on Bioluminescence and Fluorescence Resonance Energy Transfer Using Nanobubbles Ultrasound Contrast Agent. ACS Nano. 2019
DOI: 10.1021/acsnano.8b08359
https://pubs.acs.org.ccindex.cn/doi/10.1021/acsnano.8b08359
21. Nano Lett.:光激發聚乙二醇化/去聚乙二醇化納米載體用于增強腫瘤穿透
納米載體衍生的抗癌策略通常存在著腫瘤穿透性差和抗腫瘤效果不佳的問題。聚乙二醇化雖然可以提高納米顆粒的穩定性,延長其血液循環,但也進一步增大了納米顆粒的尺寸,對其在腫瘤內的穿透性產生了不利的影響。中國科學院高能物理研究所陳俊團隊和胡毅團隊合作開發了一種光觸發聚乙二醇化/去乙二醇化策略,將對近紅外(NIR)和pH雙響應的,去乙二醇化激活的iRGD用于腫瘤靶向。其中,內嵌的上轉換納米粒子(UCNPs)可以有效地將近紅外光轉化為紫外-可見光,從而切斷連接配體實現去聚乙二醇化。這種近紅外光誘導的脫聚作用顯著改善了材料的血管外滲和腫瘤的深部穿透,大大促進了腫瘤靶向藥物通過血液循環的遞送效果,進而實現增強的抗腫瘤作用。
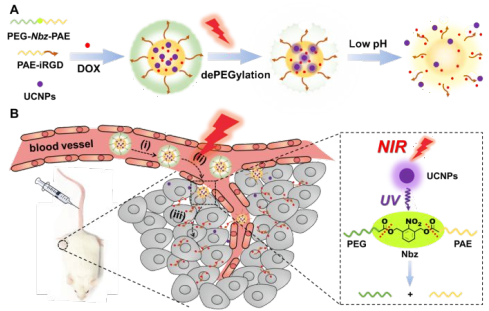
Mengxue Zhou, Jun Chen, Yi Hu. et al. Light-Triggered PEGylation/dePEGylation of the Nanocarriers for Enhanced Tumor Penetration. Nano Letters. 2019
DOI: 10.1021/acs.nanolett.9b00737
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.nanolett.9b00737











