輻射防護劑具有抵消臨床輻射脫靶不良反應和改善放療效果的重要潛力,但其仍存在無法控制藥物在人體器官中的轉運等局限性問題。有鑒于此,中山大學腫瘤防治中心楊江教授和范衛君教授評估了不同正常器官的輻射敏感性指數以作為輻射敏感性的基因組預測因子,并通過α-乳清蛋白的合成調控合理地設計了具有器官靶向選擇性(SORT)的氧化鉿納米顆粒(HfO2 NPs),使其能夠歸巢到對輻射最敏感的器官。
本文要點:
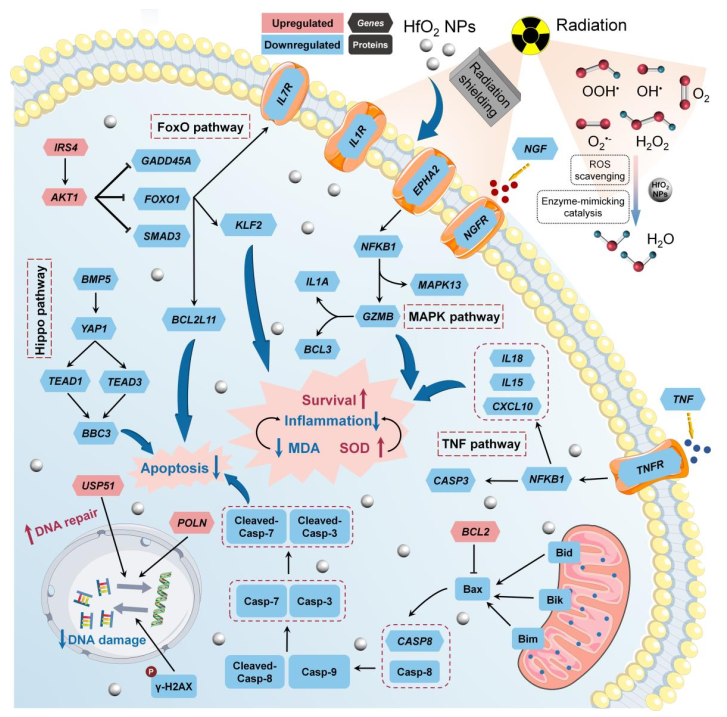
(1)HfO2 NPs(如Hensify?)通常是作為輻射增強劑,但SORT HfO2 NPs卻能夠表現出優異的輻射防護功能,這是由未折疊配體和Hf(0)/Hf(IV)氧化還原偶聯所決定的。此外,SORT HfO2的X射線衰減模式使得研究者能夠通過雙束能譜計算機斷層掃描對其器官靶向性進行放射學確認。研究發現,SORT HfO2 NPs具有強大的抗氧化活性,可催化清除活性氧,并且可以模擬多重酶催化活性。因此,SORT NPs能夠在小鼠和兔模型中有效緩解輻射誘導的DNA損傷,并在致死暴露下提供生存獲益。
(2)除了能夠抑制輻射誘導的線粒體凋亡,SORT NPs也可以通過減弱活化的FoxO,Hippo,TNF和MAPK相互作用級聯來阻止DNA損傷和炎癥。綜上所述,該研究設計了一種能夠將輻射增強劑轉變為輻射防護劑的通用方法,所開發的成像引導型SORT輻射防護劑也有望發展成為一種有效的個性化輻射防護材料。
Dingxin Liu. et al. Selective organ-targeting hafnium oxide nanoparticles with multienzyme-mimetic activities attenuate radiation-induced tissue damage. Advanced Materials. 2023
DOI: 10.1002/adma.202308098
https://onlinelibrary.wiley.com/doi/10.1002/adma.202308098



















