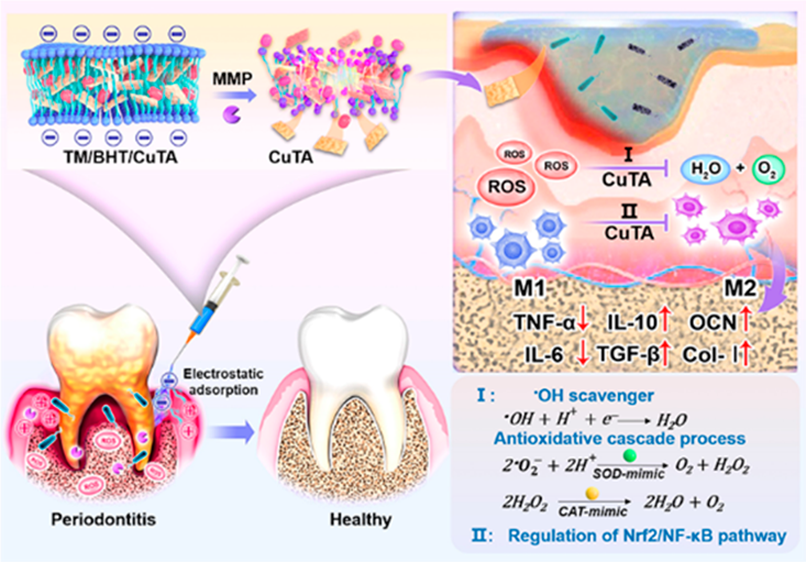
牙周炎是一種起源于牙菌斑的慢性炎癥性疾病,其特征是活性氧(ROS)、基質(zhì)金屬蛋白酶(MMP)等物質(zhì)發(fā)生過(guò)度蓄積,進(jìn)而導(dǎo)致牙周組織破壞。目前,治療牙周炎的主要方法(如局部機(jī)械清創(chuàng)和抗生素)不僅無(wú)法有效地解決難治性細(xì)菌生物膜,而且也難以改善過(guò)度的炎癥反應(yīng)和實(shí)現(xiàn)受損牙周組織的再生。有鑒于此,南昌大學(xué)王小磊教授、井岡山大學(xué)廖嵐教授和Xuexia Liu構(gòu)建了銅基納米酶(銅單寧酸配位納米片,CuTA NSs)與三聚甘油單硬脂酸酯/2,6-二叔丁基- 4-甲基苯酚(TM/BHT)水凝膠自組裝形成的TM/BHT/CuTA水凝膠體系。
本文要點(diǎn):
(1)帶負(fù)電荷的TM/BHT/CuTA可以通過(guò)靜電吸附和水解保留在帶正電荷的炎癥部位,并響應(yīng)牙周炎微環(huán)境中增加的MMP,以實(shí)現(xiàn)CuTA納米酶的按需釋放。釋放的CuTA納米酶具有抗菌和抗斑塊的特性,并且可以通過(guò)模擬超氧化物歧化酶(SOD)和過(guò)氧化氫酶(CAT)的級(jí)聯(lián)過(guò)程來(lái)清除多種ROS。
(2)此外,CuTA納米酶也能夠通過(guò)Nrf2/NF-κB通路調(diào)控巨噬細(xì)胞由M1表型向M2表型極化,進(jìn)而降低促炎細(xì)胞因子,并增加抗炎細(xì)胞因子和促進(jìn)成骨基因表達(dá),從而有效減輕牙周炎炎癥,加速組織再生。綜上所述,該研究構(gòu)建的能夠按需釋放納米酶的多功能平臺(tái)有望為牙周炎治療提供一種新的理想策略。
Yingying Xu. et al. Microenvironment-Responsive Metal-Phenolic Nanozyme Release Platform with Antibacterial, ROS Scavenging, and Osteogenesis for Periodontitis. ACS Nano. 2023
DOI: 10.1021/acsnano.3c01940
https://pubs.acs.org/doi/10.1021/acsnano.3c01940



















