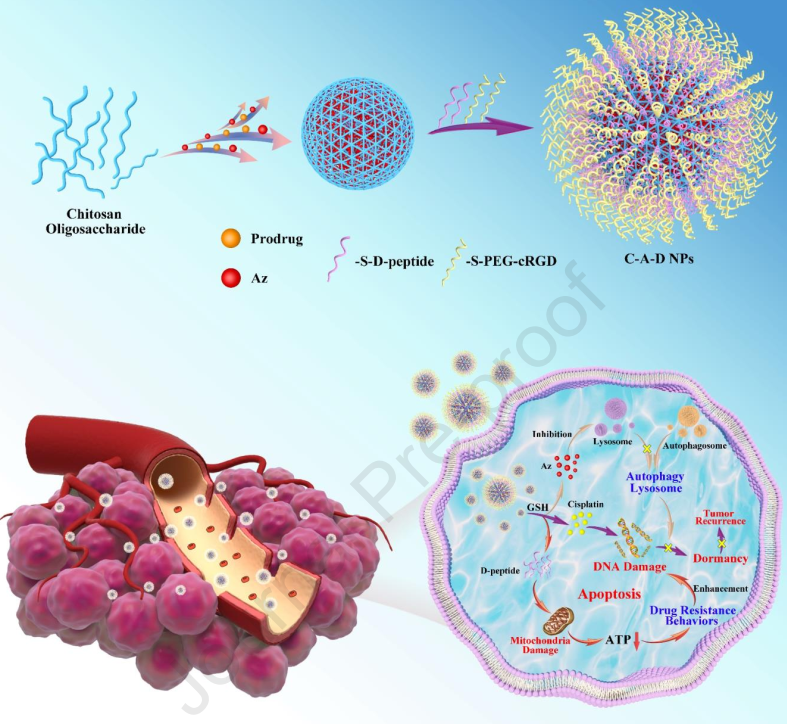
雖然抑制腫瘤細胞的能量代謝已發(fā)展成為增強化療的有效措施,但腫瘤細胞仍然可以通過進入低能量消耗的休眠狀態(tài)來進一步逃避化療的致死效應。有鑒于此,廣西科技大學Bin Li和沈陽化工大學劉丹教授構(gòu)建了對谷胱甘肽(GSH)響應的納米平臺(C-A-D NPs),以抑制腫瘤細胞的能量代謝和溶酶體活性,從而迫使腫瘤細胞保持對順鉑的敏感性。
本文要點:
(1)在該體系中,順鉑前藥會被GSH還原為順鉑,而釋放的D-肽和apoptozole (Az)能夠抑制腫瘤細胞的能量代謝和自噬-溶酶體通路。
(2)研究發(fā)現(xiàn),受抑制的自噬-溶酶體通路會阻止腫瘤細胞進入低能量的休眠狀態(tài),進而導致腫瘤細胞以高能量消耗和能量供給不足的方式喪失對順鉑致死作用的抵抗力。綜上所述,該研究構(gòu)建的工程納米平臺能夠通過抑制細胞內(nèi)的能量代謝和溶酶體活性以有效增強順鉑的化療效果,具有廣闊的臨床應用前景。
Wei Jiang. et al. An engineered nanoplatform inhibiting energy metabolism and lysosomal activity of tumor cells to multiply cisplatin-based chemotherapy. Biomaterials. 2023
https://www.sciencedirect.com/science/article/pii/S0142961223003629



















