如何開發用于細胞內遞送和實現有效載荷的受控釋放的精確工程化載體仍然是一項嚴峻的挑戰。DNA納米材料有望為解決該難題提供一種潛在方案。有鑒于此,法赫德國王石油與礦業大學Jackie Y. Ying和新加坡科技研究局新加坡科技研究局Yuwei Hu構建了一種自分解的DNA納米凝膠疫苗,其可以在細胞內被無痕地釋放,以激活免疫反應。
本文要點:
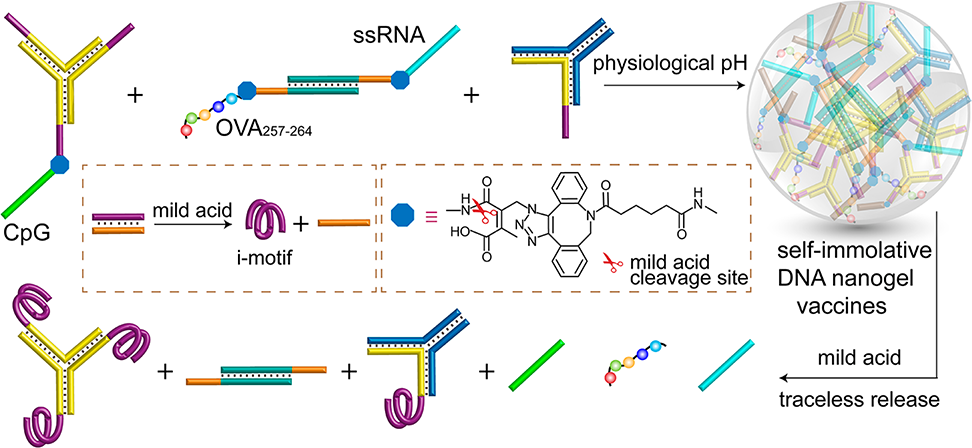
(1)實驗設計了三個具有富含胞嘧啶懸垂結構域的構建塊,并將其自組裝成大小可控的DNA納米凝膠框架。隨后,研究者通過不耐酸的化學連接子將兩種寡核苷酸激動劑和一種抗原肽連接到構建塊上。研究發現,被內化到酸性核內體后,形成的i-基序構型會導致該DNA納米凝膠疫苗發生解離。
(2)不耐酸的化學連接子被切斷后,激動劑和抗原會以其原始形式被釋放,從而激活抗原呈遞細胞和免疫反應。綜上所述,該研究開發了一種構建遞送平臺的新策略,可實現胞內刺激觸發的治療藥物的無痕釋放。
Yuwei Hu. et al. A Self-Immolative DNA Nanogel Vaccine toward Cancer Immunotherapy. Nano Letters. 2023
DOI: 10.1021/acs.nanolett.3c02449
https://pubs.acs.org/doi/10.1021/acs.nanolett.3c02449



















