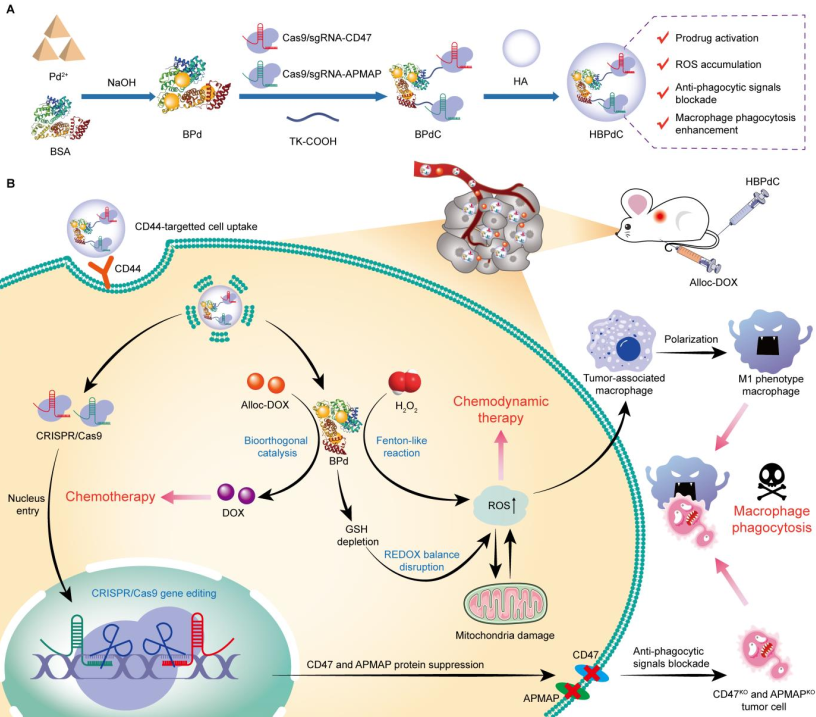
利用巨噬細胞吞噬腫瘤細胞已發展成為一種重要的腫瘤治療策略。然而,腫瘤微環境中的免疫抑制性M2型巨噬細胞和腫瘤細胞高表達的抗吞噬信號仍會嚴重影響該策略的治療效果。有鑒于此,南京大學宋玉君教授開發了一種可基因編輯的鈀基生物正交納米平臺(HBPdC),其由CRISPR/Cas9基因編輯系統連接的鈀納米簇和透明質酸表面層所組成。
本文要點:
(1)HBPdC納米平臺具有良好的腫瘤靶向性,能夠在腫瘤微環境中引發類芬頓反應,進而產生活性氧以用于化學動力學治療和實現巨噬細胞的M1型極化,從而直接清除腫瘤細胞,并刺激巨噬細胞的抗腫瘤反應。研究發現,HBPdC可通過基因編輯重編程腫瘤細胞,降低CD47和脂肪細胞質膜相關蛋白的表達,從而促進其被巨噬細胞識別和吞噬。
(2)此外,HBPdC也能夠通過生物正交催化誘導分離的前藥被激活,從而通過化療增強腫瘤細胞的死亡。實驗結果表明,HBPdC中的Pd納米團簇能夠通過基本代謝途徑被充分清除,由此表明其具有良好的生物相容性和生物安全性。綜上所述,該研究開發的HBPdC系統能夠顯著增強巨噬細胞的吞噬作用,其在腫瘤治療領域中具有廣闊的應用前景。
Shujun Feng. et al. A Gene-Editable Palladium-Based Bioorthogonal Nanoplatform Facilitates Macrophage Phagocytosis for Tumor Therapy. Angewandte Chemie International Edition. 2023
DOI: 10.1002/anie.202313968
https://onlinelibrary.wiley.com/doi/10.1002/anie.202313968




















