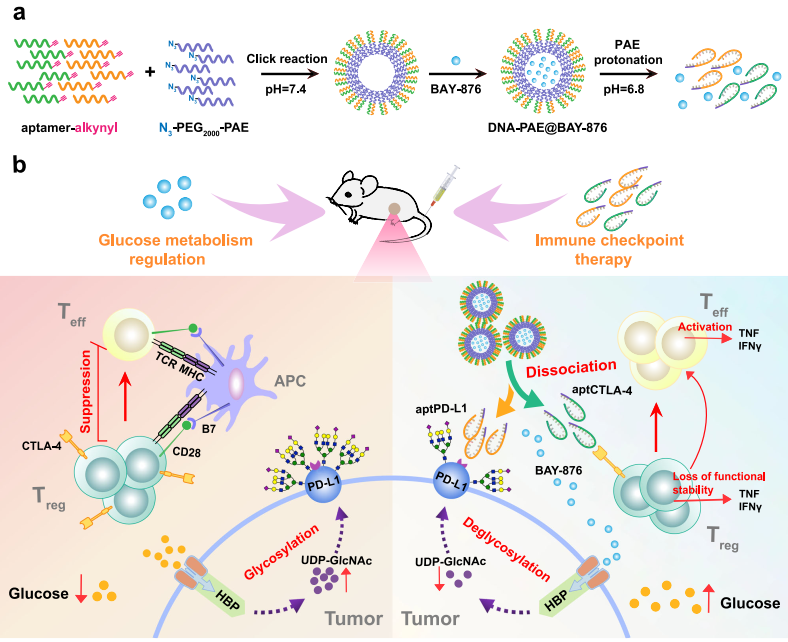
免疫檢查點抑制劑(ICI)是一種治療三陰性乳腺癌(TNBC)的潛在方法。然而,糖酵解高(TNBC細胞的標志)會驅動腫瘤固有的PD-L1糖基化,并增強調節性T細胞功能,從而影響ICI的療效。有鑒于此,重慶大學胡燕教授、羅忠教授和李孟桓教授構建了一種基于自組裝的適配體-聚合物偶聯物、可由腫瘤微環境激活的納米組裝體,并將其用于靶向遞送葡萄糖轉運蛋白1抑制劑BAY-876(DNA-PAE@BAY-876)以重塑免疫抑制性TME,從而增強ICI的治療響應。
本文要點:
(1)實驗合成了聚β-氨基酯(PAE)修飾的PDL1和CTLA-4拮抗適配體(aptPD-L1和aptCTLA-4),并將它們共組裝成可負載BAY-876的超分子納米組裝體。研究發現,酸性腫瘤微環境會導致PAE發生質子化,并觸發納米組裝體的解離,從而釋放BAY-876和適配體。BAY-876能夠選擇性地抑制TNBC糖酵解,以剝奪尿苷二磷酸N-乙酰葡糖胺,并下調PD-L1糖基化,從而促進PD-L1識別aptPD-L1,以增強抗PD-L1治療。
(2)與此同時,BAY-876治療還可以提高對腫瘤內調節性T細胞(Tregs)的葡萄糖供應,使其重新到達免疫刺激狀態,從而能夠與aptCTLA-4介導的免疫檢查點抑制相協同以有效消除Treg介導的免疫抑制。綜上所述,該研究開發的DNA-PAE@BAY-876能夠在TNBC臨床前模型中有效地實現對免疫抑制性腫瘤微環境的重編程,為TNBC的臨床免疫治療提供了一種獨特的新方法。
Xijiao Ren. et al. Inhibition of glycolysis-driven immunosuppression with a nano-assembly enhances response to immune checkpoint blockade therapy in triple negative breast cancer. Nature Communications. 2023
https://www.nature.com/articles/s41467-023-42883-2



















