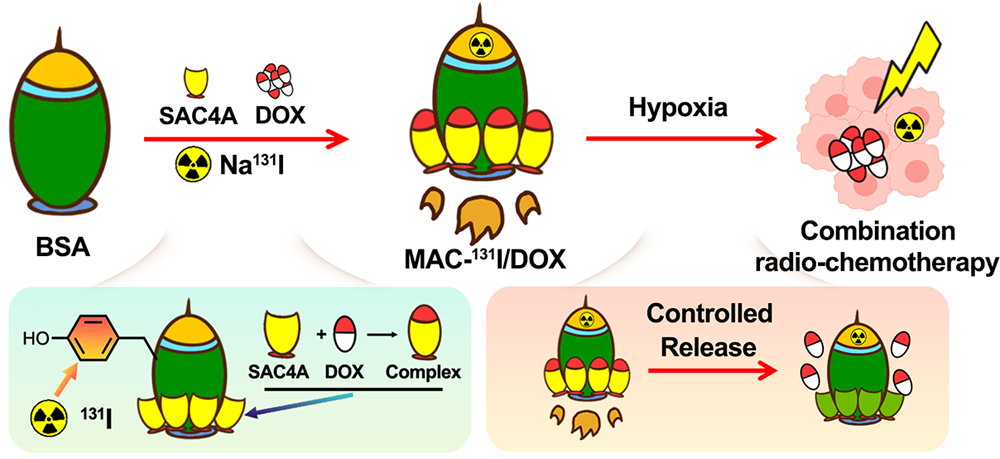
在基于放射性核素的放化療過程中,將放射性核素和抗癌藥物精準遞送到腫瘤組織是保證藥物的協同作用和獲得最佳治療效果的關鍵。然而,目前的共遞送載體往往依賴于物理包埋/吸附等過程來負載抗癌藥物,缺乏精準的載藥和釋放機制,從而導致其會產生難以預測的聯合效應。有鑒于此,天津醫科大學Zhanzhan Zhang、孫少凱教授、孟召偉教授和南開大學劉陽教授開發了一種大環-白蛋白偶聯物(MAC),其可以實現抗癌藥物的精確裝載和控制釋放。
本文要點:
(1)實驗通過將多個大環宿主(sulfonate azocalix[4]arenes,SAC4A)偶聯到白蛋白分子上而構建了MAC。MAC可通過主-客體相互作用實現抗癌藥物的精準負載以及放射性核素的位點特異性標記。研究發現,MAC會在乏氧條件下發生降解,從而使負載的藥物在到達腫瘤組織后被有效釋放。
(2)實驗結果表明,在荷乳腺癌細胞(4T1)小鼠模型中,MAC能夠通過靶向遞送放射性核素和抗癌藥物以實現高效的腫瘤診斷和聯合放化療。綜上所述,該研究開發的MAC能夠為實現有效的聯合放化療提供一個新的平臺。
Shujie Li. et al. Macrocyclic-Albumin Conjugates for Precise Delivery of Radionuclides and Anticancer Drugs to Tumors. ACS Nano. 2023
DOI: 10.1021/acsnano.3c04718
https://pubs.acs.org/doi/10.1021/acsnano.3c04718



















