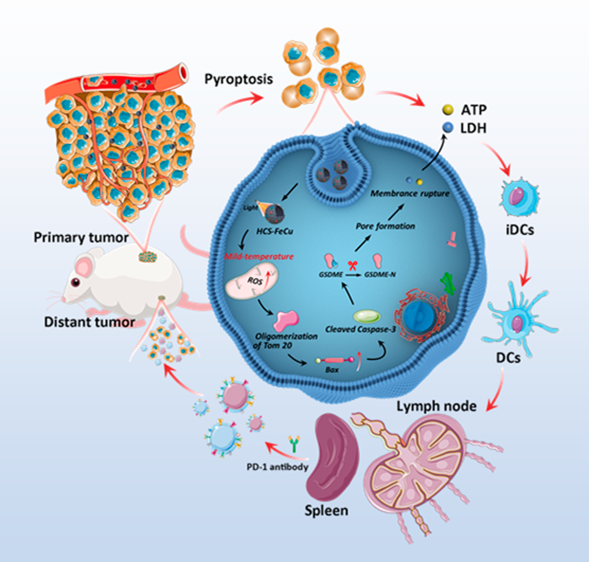
免疫檢查點阻斷(ICB)抗體免疫療法已被證明能夠對多種癌癥產生臨床治療收益。然而,腫瘤免疫原性缺陷和免疫抑制性的腫瘤微環境仍會嚴重抑制腫瘤免疫治療的效果。細胞焦亡是一種細胞程序性死亡形式,可釋放腫瘤抗原,激活有效的腫瘤免疫原性,以提高ICB的效率。然而,目前有效的細胞焦亡用于腫瘤治療的研究有限。有鑒于此,中南大學劉又年教授、鄧留教授和華中師范大學朱成周教授開發了一種基于空心碳納米酶、溫和熱增強焦亡介導的免疫治療策略,它可以在腫瘤微環境中特異性地放大氧化應激觸發的焦亡,并同步增強焦亡介導的抗癌反應。
本文要點:
(1)經鐵和銅原子修飾的空心碳球(HCS-FeCu)具有多種模擬酶活性,其在光激活下可通過活性氧(ROS)-Tom20-Bax-Caspase 3-gasdermin E(GSDME)信號通路誘導細胞焦亡。體內外抗腫瘤實驗結果表明,HCS-FeCu納米酶能夠誘導產生顯著的細胞焦亡。此外,溫和光熱激活的細胞焦亡能夠聯合抗PD-1以增強抗腫瘤免疫治療。
(2)理論計算結果表明,溫和光熱可刺激產生高能電子,進而增強HCS-FeCu表面與吸附氧的相互作用,以促進氧分子的活化,從而提高ROS的產生效率。綜上所述,該研究工作開發了一種能夠有效地將免疫“冷”腫瘤轉化為“熱”腫瘤的新方法,其對于改善臨床免疫治療而言具有重要意義。
Na Tao. et al. A Mild Hyperthermia Hollow Carbon Nanozyme as Pyroptosis Inducer for Boosted Antitumor Immunity. ACS Nano. 2023
DOI: 10.1021/acsnano.3c07601
https://pubs.acs.org/doi/10.1021/acsnano.3c07601



















