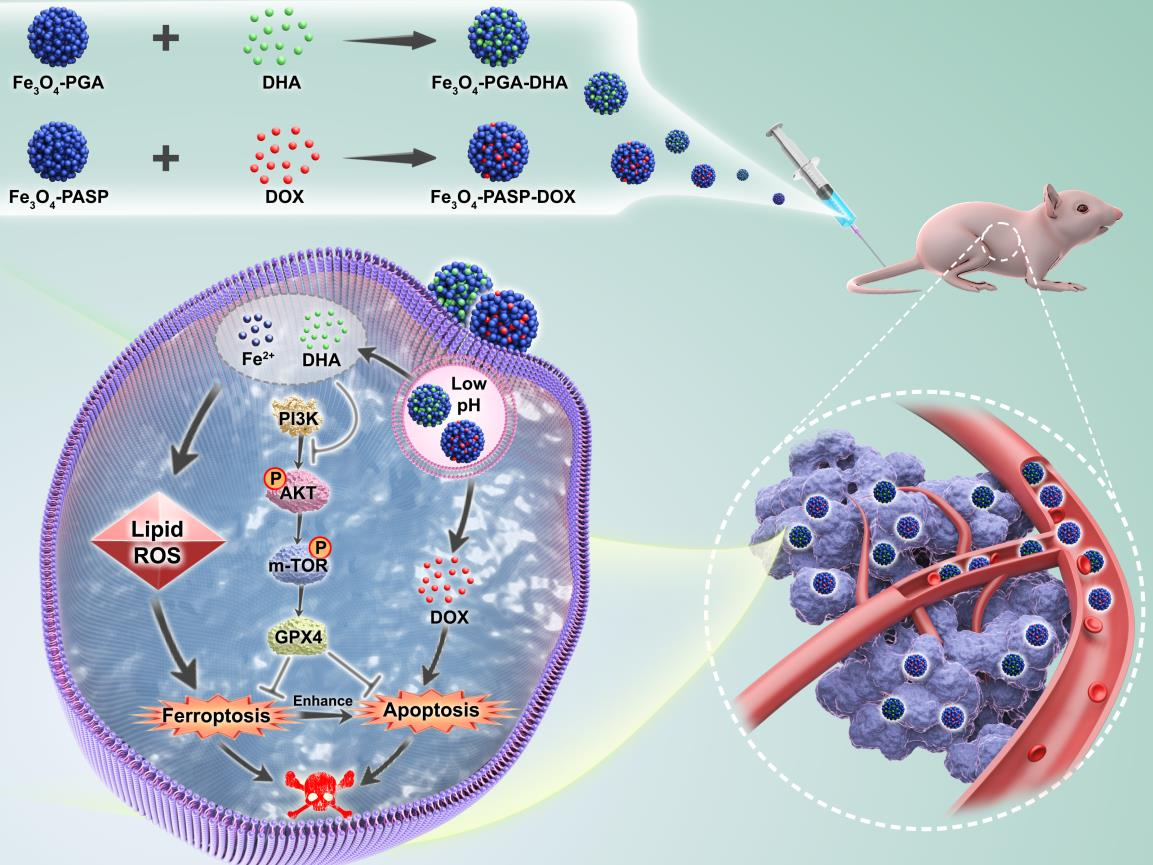
三陰性乳腺癌(TNBC)具有異質(zhì)性、預(yù)后差和化療耐藥等特點,會給患者造成極大的痛苦。鐵死亡是一種具有鐵依賴性、通過積累細胞內(nèi)的脂質(zhì)過氧化物以到達致死水平的氧化損傷,其在TNBC的治療中能夠發(fā)揮至關(guān)重要的作用。為了明確三陰性乳腺癌化療耐藥與鐵死亡的關(guān)系,研究者分析了GSE205551的單細胞RNA測序公共數(shù)據(jù)集,發(fā)現(xiàn)Gpx4在對DOX耐藥的TNBC細胞中的表達會明顯高于其在對DOX敏感的TNBC細胞中的表達。有鑒于此,復旦大學楊武利教授、龐志清教授和曾賢研究員設(shè)計了一種通過抑制Gpx4的表達以誘導鐵死亡,從而降低TNBC對DOX的耐藥性,提高對TNBC的化療效果的策略。
本文要點:
(1)實驗將負載雙氫青蒿素(DHA)、聚谷氨酸穩(wěn)定的Fe3O4磁性納米粒子(Fe3O4-PGA-DHA)與負載阿霉素、聚天門冬氨酸穩(wěn)定的Fe3O4磁性納米粒子(Fe3O4-PASP-DOX)進行聯(lián)合,以用于實現(xiàn)對三陰性乳腺癌的鐵死亡增強化療。與Fe3O4-PASP-DOX相比,F(xiàn)e3O4-PGA-DHA+Fe3O4-PASP-DOX對不同TNBC細胞株的細胞毒性有顯著增強,并且可以增加細胞內(nèi)活性氧和脂質(zhì)過氧化物的積累。
(2)轉(zhuǎn)錄組學分析結(jié)果表明,F(xiàn)e3O4-PGA-DHA誘導的鐵死亡能夠增強FFe3O4-PASP-DOX誘導的細胞凋亡。Fe3O4-PGA-DHA+Fe3O4-PASP-DOX可通過抑制PI3K/AKT/mTOR/GPX4通路誘導MDA-MB-231細胞發(fā)生鐵死亡。實驗結(jié)果表明,F(xiàn)e3O4-PGA-DHA+Fe3O4-PASP-DOX能夠在MDA-MB-231荷瘤小鼠模型中表現(xiàn)出較好的抗腫瘤效果,具有提高對TNBC的治療效果的重要潛力。
Jiaxin Zhang. et al. Ferroptosis-enhanced chemotherapy for triple negative breast cancer with magnetic composite nanoparticles. Biomaterials. 2023
https://www.sciencedirect.com/science/article/pii/S0142961223004039



















