納米藥物的臨床應用仍面臨著化療藥物在腫瘤內的生物利用度差、安全性提高但療效受限等挑戰。有鑒于此,中國藥科大學丁楊教授、張華清研究員和周建平教授開發了一種酶沉默的納米海綿,其具有很長的有效期,能夠可逆地呼出/吸入阿霉素(DOX),以實現連續的細胞間接力藥物遞送,并改善藥物的瘤內保留效果。
本文要點:
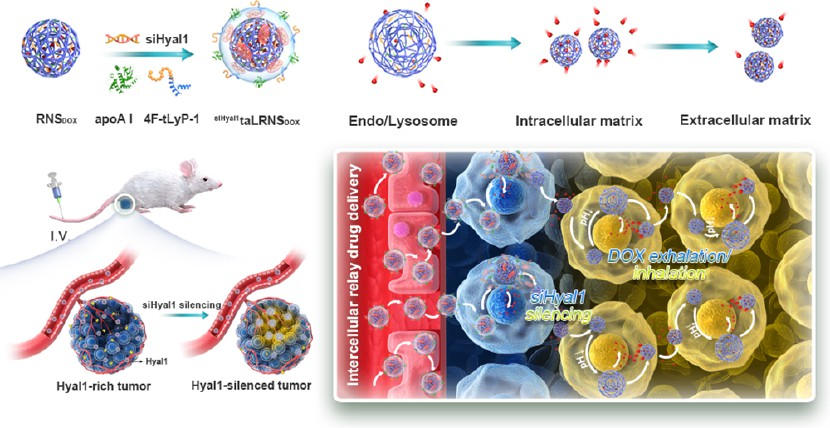
(1)該納米海綿由陽離子脂質覆蓋透明質酸衍生物聚兩性電解質內核(用于包裹DOX和靶向透明質酸酶-1的siRNA(siHyal1))以及由融合肽4F-tLyP-1(載脂蛋白A-I(apoA-I)模擬肽4F和tLyP-1融合而成,用于實現腫瘤歸巢與和外滲進入到腫瘤間質)修飾的脂蛋白殼所組成。在細胞內/細胞間的pH變化的觸發下,該納米海綿內核可以在內涵體/溶酶體(pH 5.0)中發生可逆性膨脹,以釋放DOX。在細胞質中(pH 7.4),納米海綿內核會因發生去質子化而收縮,以重新負載DOX,并在通過高爾基體分泌到細胞外基質(pH 6.8)后繼續其行為,從而大大提高腫瘤內的DOX保留和利用度。
(2)與此同時,sihyal1特異性沉默也能夠延長納米海綿的瘤內有效期,并保證載體和藥物在穿梭于多層腫瘤細胞時具有時空一致性。實驗結果表明,該納米海綿可在99.1%腫瘤球體和80.1%原位腫瘤模型中實現有效的腫瘤抑制。綜上所述,該研究開發了一種能夠實現主動的細胞間接力藥物遞送的智能納米海綿,其可以提高藥物在腫瘤內的生物利用度,并增強對實體瘤的化療效果。
Xiaoyu Yang. et al. Enzyme-Silenced Nanosponges Prolong Intratumoral Lifetime to Facilitate Intercellular Relay Drug Delivery and Treatment Efficacy. ACS Nano. 2023
DOI: 10.1021/acsnano.3c06544
https://pubs.acs.org/doi/10.1021/acsnano.3c06544



















