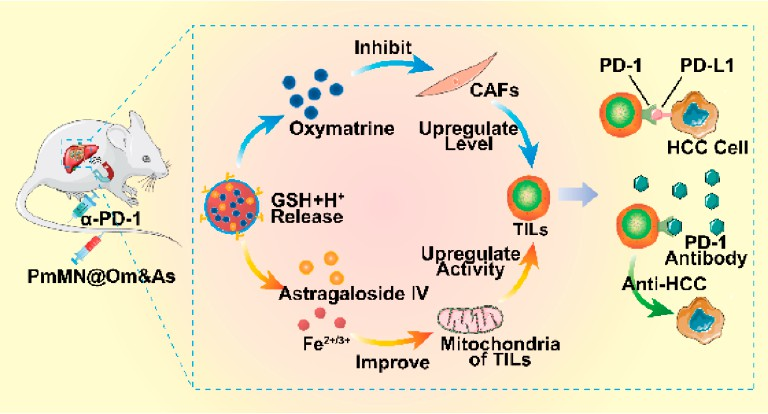
程序性細胞死亡蛋白1(PD-1)抑制劑是最常見的免疫檢查點抑制劑,也是一種有望用于治療肝細胞癌(HCC)的潛在藥物。然而,由于腫瘤浸潤T淋巴細胞(TILs)的水平和活性不足,因此PD-1抑制劑在臨床環境中對HCC患者的客觀緩解率仍然較低(15% ~ 20%)。聯合給藥氧化苦參堿(Om)和黃芪甲苷(As)可通過抑制腫瘤相關成纖維細胞(CAFs)的活化來提高TILs水平,并通過增強線粒體功能來提高TILs的活性。有鑒于此,南京中醫藥大學陳彥研究員和霍介格教授構建了一種基于磁性金屬-有機框架(MOF)的納米平臺,并利用血小板膜對其進行包覆(PmMN@Om&As),以同時將Om和As遞送到肝癌微環境中。
本文要點:
(1)PmMN@Om&As具有較高的總載藥量(33.77 wt %)和良好的免疫逃逸性能。此外,它還可以在磁場中實現對肝癌組織的靶向,并持久地發揮作用。研究發現,HCC微環境能夠加速PmMN@Om&As的分解和Om&As的釋放,進而通過調節CAFs和TILs的線粒體功能提高TILs的水平和活性。
(2)此外,該遞送載體也可以與Om&As相協同,以通過增強TILs的氧消耗率和質子流出率上調TILs的線粒體功能。實驗結果表明,PmMN@Om&As與α-PD-1相聯合的治療策略能夠實現高達84.15%的腫瘤抑制率,并顯著延長小鼠的生存時間。綜上所述,該研究能夠為提高肝癌免疫治療的抗腫瘤效果提供新的思路。
Hong Guo. et al. Magnetic Metal?Organic Framework-Based Nanoplatform with Platelet Membrane Coating as a Synergistic Programmed Cell Death Protein 1 Inhibitor against Hepatocellular Carcinoma. ACS Nano. 2023
DOI: 10.1021/acsnano.3c07885
https://pubs.acs.org/doi/10.1021/acsnano.3c07885



















