向周圍健康腦組織發(fā)生彌漫性浸潤是膠質(zhì)母細胞瘤的一大特點,這也使得對膠質(zhì)母細胞瘤進行治療成為了一項嚴峻的挑戰(zhàn)。完全手術(shù)切除膠質(zhì)母細胞瘤非常困難,而全身給藥的策略也無法實現(xiàn)充分的腫瘤暴露以防止局部復發(fā)。對流增強給藥(CED)是一種直接將治療藥物注入腦腫瘤組織的方法,但其效果往往也會受到快速的藥物清除和脫靶細胞攝取等問題的限制。利用納米顆粒(NPs)進行包封可以延長局部遞送藥物的保留時間,并同時實現(xiàn)對膠質(zhì)母細胞瘤的特異性靶向。然而,大腦的細胞外結(jié)構(gòu)也會嚴重影響NPs的分布。有鑒于此,麻省理工學院Paula T. Hammond通過層層組裝(LbL)來研究NP表面化學的影響,以設計能夠在腦組織中實現(xiàn)廣泛的空間分布和特異性靶向膠質(zhì)母細胞瘤的藥物載體。
本文要點:
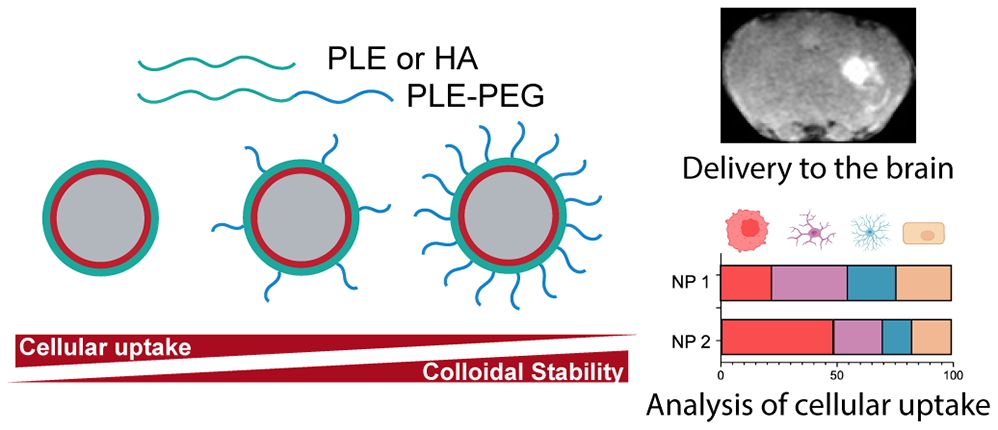
(1)研究發(fā)現(xiàn),聚-L-谷氨酸和透明質(zhì)酸是體外靶向膠質(zhì)母細胞瘤細胞的有效表面化學物質(zhì)。共吸附含有少量聚乙二醇化聚電解質(zhì)的聚合物能夠提高膠體穩(wěn)定性,而不會影響對癌細胞的選擇性。
(2)經(jīng)體內(nèi)CED后,釓功能化的LBL納米粒子可實現(xiàn)MRI可視化成像,其分布體積是脂質(zhì)體的3倍,保留半衰期(13.5天)是脂質(zhì)體的2倍。對CED治療小鼠的原位腦腫瘤進行流式細胞術(shù)分析的結(jié)果表明,與非功能化的脂質(zhì)體相比,癌細胞對LBL NPs的攝取較高,而健康細胞對LBL NPs的攝取則較低。綜上所述,該研究能夠為定制模塊化遞送系統(tǒng)以適應不同的治療應用提供新的見解。
Andrew J. Pickering. et al. Layer-by-Layer Polymer Functionalization Improves Nanoparticle Penetration and Glioblastoma Targeting in the Brain. ACS Nano. 2023
DOI: 10.1021/acsnano.3c09273
https://pubs.acs.org/doi/10.1021/acsnano.3c09273




















