隨著對鐵死亡的研究不斷深入,其在腫瘤中的作用和治療潛力逐漸顯現(xiàn)。然而,這些研究發(fā)現(xiàn)尚未轉(zhuǎn)化為有效的治療方法。因治療手段有限,膠質(zhì)母細胞瘤(GBM)患者仍面臨著預(yù)后不佳等嚴峻挑戰(zhàn)。有鑒于此,空軍軍醫(yī)大學(xué)顧錦濤教授、李萌教授和西京醫(yī)院韓東暉在有鐵死亡誘導(dǎo)劑(RSL3)存在的情況下進行了全基因組CRISPR-Cas9篩選,以確定參與鐵死亡過程的關(guān)鍵驅(qū)動基因。
本文要點:
(1)研究發(fā)現(xiàn),ALOX15是一種關(guān)鍵的脂氧合酶(LOX),也是鐵死亡的重要驅(qū)動因子。利用小激活RNA(Small activating RNA,saRNA)介導(dǎo)ALOX15表達能夠促進GBM細胞發(fā)生鐵死亡。隨后,研究者在負載saALOX15的介孔聚多巴胺(MPDA)表面包被了Angiopep-2修飾的巨噬細胞膜(MMs),以減少單核吞噬細胞系統(tǒng)(MPS)對該復(fù)合物的清除,并在特異性靶向治療原位GBM期間改善該穿過血腦屏障(BBB)的能力。
(2)該復(fù)合納米顆粒(NPs)可通過介導(dǎo)線粒體功能障礙和線粒體形態(tài)異常來誘導(dǎo)鐵死亡。體內(nèi)實驗結(jié)果表明,修飾后的納米粒子能夠靶向作用于GBM細胞,顯著抑制GBM的進展,并能提高GBM的放射敏感性。綜上所述,該研究結(jié)果不僅證明了ALOX15是一個重要的GBM治療靶點,也設(shè)計了一種依賴于MMs的生物學(xué)特性的仿生策略,以增強納米粒子治療GBM的體內(nèi)性能。
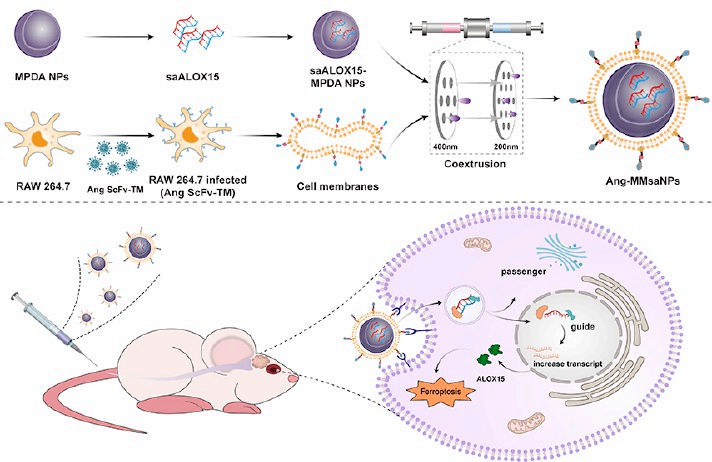
Zhengcong Cao. et al. Biomimetic Macrophage Membrane-Camouflaged Nanoparticles Induce Ferroptosis by Promoting Mitochondrial Damage in Glioblastoma. ACS Nano. 2023
DOI: 10.1021/acsnano.3c07555
https://pubs.acs.org/doi/10.1021/acsnano.3c07555



















