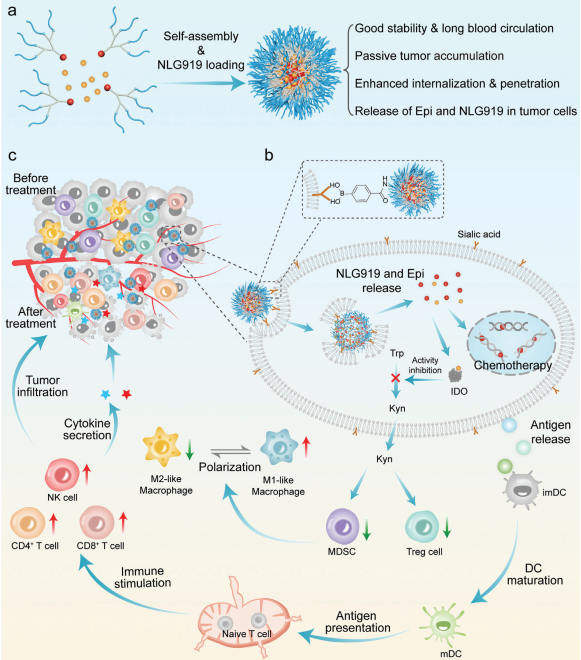
化療藥物在腫瘤內的積累效率不佳和復雜的免疫抑制微環(huán)境等問題會降低免疫應答率和治療效果。利用靶向配體對對藥物進行表面修飾可以促進其被細胞內吞,但修飾后的藥物往往也會受到免疫識別和清除。有鑒于此,四川大學羅奎教授開發(fā)了一種結合免疫原性細胞死亡(ICD)誘導劑(表柔比星,Epi)和吲哚胺2,3-雙加氧酶1(IDO1)抑制劑(NLG919)、苯基硼酸(PBA)基團保護的樹狀納米藥物,并將其用于腫瘤化學-免疫治療。
本文要點:
(1)負載NLG919、與Epi共軛的聚乙二醇化樹狀聚合物與硼酸鍵(NLG919@Epi-DBP)橋接后能夠在循環(huán)過程中保持穩(wěn)定的納米結構。在偏酸性的條件下,PBA基團會被暴露并與腫瘤細胞膜上的唾液酸殘基發(fā)生相互作用,以增強NLG919@Epi-DBP的細胞內化和穿透。在pH為5.0時,NLG919@Epi-DBP會迅速解體,以釋放Epi和NLG919。研究發(fā)現,Epi可高效地誘導腫瘤細胞發(fā)生ICD,以引起強烈的免疫反應。
(2)此外,抑制IDO1的活性能夠下調L-色氨酸向犬尿氨酸的代謝,進而導致免疫抑制細胞募集減少,從而實現對腫瘤免疫微環(huán)境的調節(jié)。實驗結果表明,該研究設計的策略能夠誘導產生強大的免疫反應,并重塑免疫抑制微環(huán)境,以顯著增強化學-免疫治療效果。
Yunkun Li. et al. Dendritic Nanomedicine with Boronate Bonds for Augmented Chemo-Immunotherapy via Synergistic Modulation of Tumor Immune Microenvironment. Advanced Materials. 2023
DOI: 10.1002/adma.202307263
https://onlinelibrary.wiley.com/doi/10.1002/adma.202307263



















