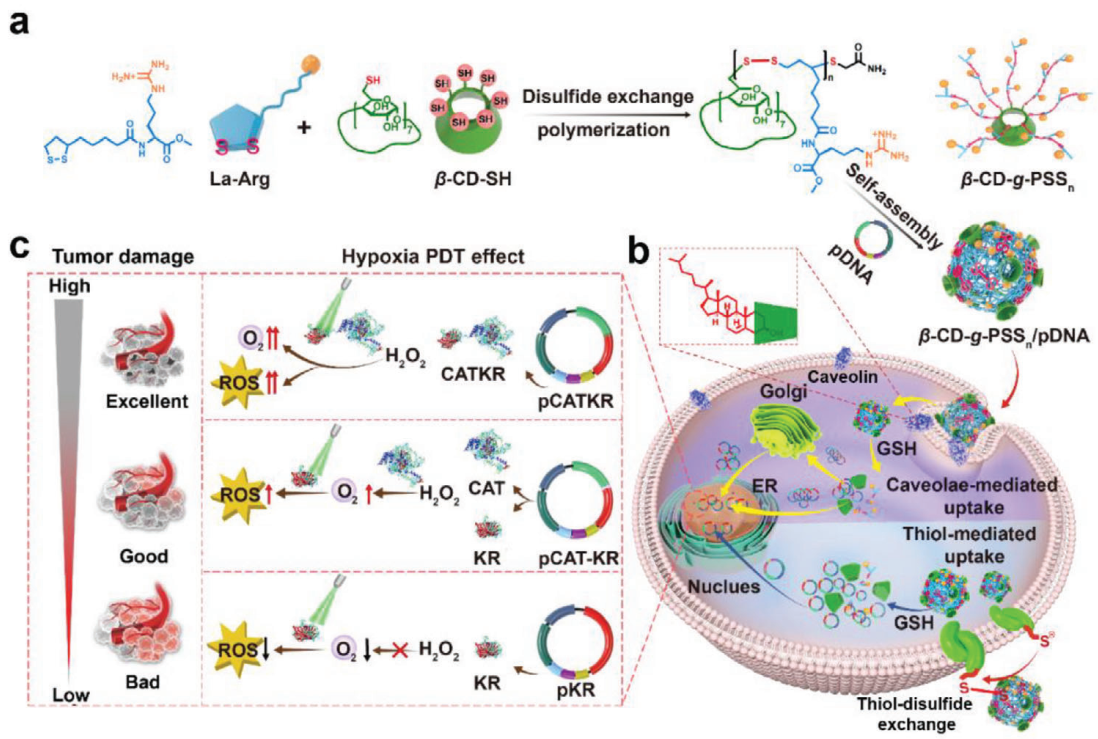
有效的遞送載體和多功能質粒的缺乏嚴重限制了腫瘤基因治療的發展。有鑒于此,北京化工大學徐福建教授、Meng Qin和俞丙然教授通過溫和可控的雙硫交換聚合反應設計并制備了一種具有β-環糊精內核的星狀陽離子聚合物(β-CD-g-PSSn),其能夠實現小窩介導的細胞內吞,以用于癌癥治療。
本文要點:
(1)β-CD-g-PSSn/pDNA復合物會被轉運到高爾基體和內質網中。β-CD-g-PSSn載體中的二硫化物會被腫瘤細胞內的谷胱甘肽降解,以促進細胞內pDNA的釋放,并且能夠降低其體內外毒性。此外,實驗也構建了一種雙功能融合質粒pCATKR,其可在同一靶細胞中表達與毒殺紅蛋白(KR)融合的過氧化氫酶(CAT)(CATKR),以實現基因級聯催化治療。
(2)與pCAT-KR(在同一細胞中分開表達CAT和KR)相比,pCATKR能更有效地分解過氧化氫,緩解腫瘤乏氧,并在溫和的激光照射下表現出更強的活性氧(ROS)產生性能,以實現更為顯著的抗腫瘤級聯光動力效應。研究發現,該融合蛋白可以縮短CAT和KR催化中心之間的距離,從而提高ROS的產生效率。綜上所述,該研究工作構建了一種可生物降解、具有小窩介導的細胞內吞特性的高性能載體,能夠為實現對多功能質粒的有效遞送提供一個新的策略。
Dan Yu. et al. Controllable Star Cationic Poly(Disulfide)s Achieve Genetically Cascade Catalytic Therapy by Delivering Bifunctional Fusion Plasmids. Advanced Materials. 2023
DOI: 10.1002/adma.202307190
https://onlinelibrary.wiley.com/doi/10.1002/adma.202307190




















