光動力療法(PDT)可通過光敏劑產生活性氧(ROS)來減少癌細胞和癌前細胞。目前,已有多種類型的光敏劑被報道,它們在疾病治療方面也表現出了廣闊的前景。然而,光敏劑的治療效果仍會受到腫瘤微環境的影響。并且會由于發生非特異性激活而導致安全性問題。有鑒于此,慶熙大學Dokyoung Kim、Jong Min An和Junyang Jung開發了一種基于原位可激活型硝基苯-半胱氨酸-銅(II)納米復合物(NCCNs)的納米治療方法,該策略可在癌細胞內發揮作用。
本文要點:
(1)NCCNs中的CyP具有諸多獨特的性能:(1)明亮的近紅外成像、(2)化學動力學治療作用、(3)光動力學治療作用(I和II型)以及(4)在光照下抗腫瘤早期血管生成的抗癌作用,因此具有實現程序化光動力腫瘤治療的重要潛力。
(2)綜上所述,該研究工作能夠為開發新型有效的癌癥治療方法開辟新的途徑,以進一步推動臨床醫學領域的發展。
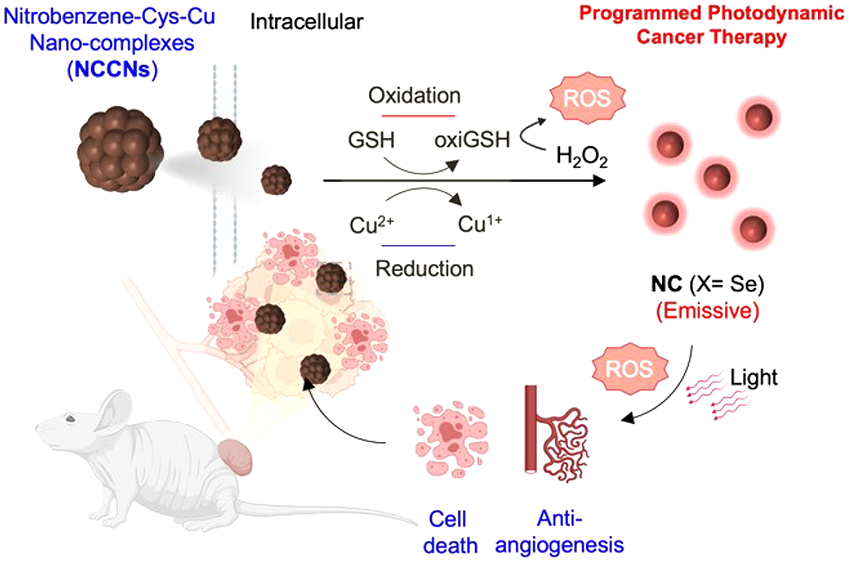
Jisoo Kang. et al. In Situ Activatable Nitrobenzene?Cysteine?Copper(II) Nanocomplexes for Programmed Photodynamic Cancer Therapy. Journal of the American Chemical Society. 2023
DOI: 10.1021/jacs.3c09339
https://pubs.acs.org/doi/10.1021/jacs.3c09339



















