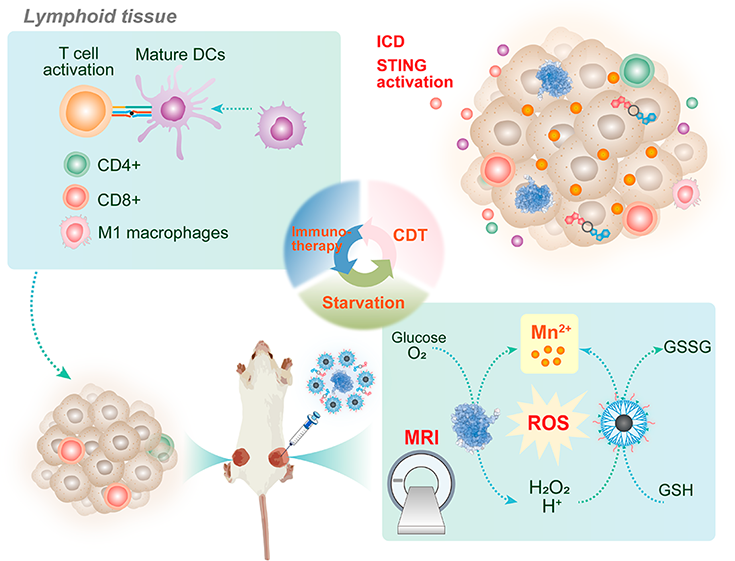
如何開發(fā)既能發(fā)揮有效的腫瘤治療效果,又能產(chǎn)生所需的抗腫瘤免疫應(yīng)答的納米級藥物遞送系統(tǒng)是一項極具挑戰(zhàn)性的難題。有鑒于此,東華大學(xué)史向陽教授和沈明武研究員構(gòu)建了一種包封二氧化錳(MnO2)的樹狀聚合物納米載體,并將其用于共遞送葡萄糖氧化酶(GOx)和環(huán)GMP-AMP(cGAMP,一種干擾素基因刺激因子(STING)激動劑),以改善腫瘤化學(xué)動力學(xué)/饑餓/免疫治療。
本文要點:
(1)實驗首先合成了甲氧基聚乙二醇(mPEG)和苯硼酸(PBA)修飾的第5代(G5)聚(酰胺-胺)樹狀聚合物,并利用其對MnO2納米粒子(NPs)進(jìn)行包封以構(gòu)建雜化的MnO2@G5-mPEG?PBA(MGPP) NPs。具有粒徑為2.8 nm的MnO2內(nèi)核的MGPP納米粒子能夠高效地消耗谷胱甘肽和釋放Mn2+,其在模擬腫瘤微環(huán)境的條件下可實現(xiàn)類芬頓反應(yīng)和T1加權(quán)的磁共振(MR)成像。研究發(fā)現(xiàn),MGPP介導(dǎo)的GOx遞送有助于在體外增強(qiáng)對癌細(xì)胞的化學(xué)動力學(xué)/饑餓治療,而共遞送的cGAMP則可以有效觸發(fā)免疫原性細(xì)胞死亡(ICD),以顯著地促進(jìn)樹突狀細(xì)胞的成熟。
(2)在小鼠雙側(cè)結(jié)直腸腫瘤模型中,該樹狀聚合物納米遞送系統(tǒng)能夠表現(xiàn)出強(qiáng)大的抗腫瘤性能和遠(yuǎn)端效應(yīng),可大大提高小鼠的總體生存率。實驗結(jié)果表明,該樹突狀分子介導(dǎo)的共遞送不僅能夠?qū)崿F(xiàn)Mn2+與GOx和cGAMP的協(xié)同作用,以進(jìn)行化學(xué)動力學(xué)/饑餓治療觸發(fā)的ICD和增強(qiáng)的STING激活,促進(jìn)全身抗腫瘤免疫應(yīng)答,而且還可以實現(xiàn)T1加權(quán)的腫瘤磁共振成像。綜上所述,該研究設(shè)計的納米平臺能夠為增強(qiáng)抗腫瘤治療的免疫應(yīng)答提供重要的借鑒和參考。
Yue Gao. et al. Manganese Dioxide-Entrapping Dendrimers Co-Deliver Protein and Nucleotide for Magnetic Resonance Imaging-Guided Chemodynamic/Starvation/Immune Therapy of Tumors. ACS Nano. 2023
DOI:
https://pubs.acs.org/doi/10.1021/acsnano.3c08174




















