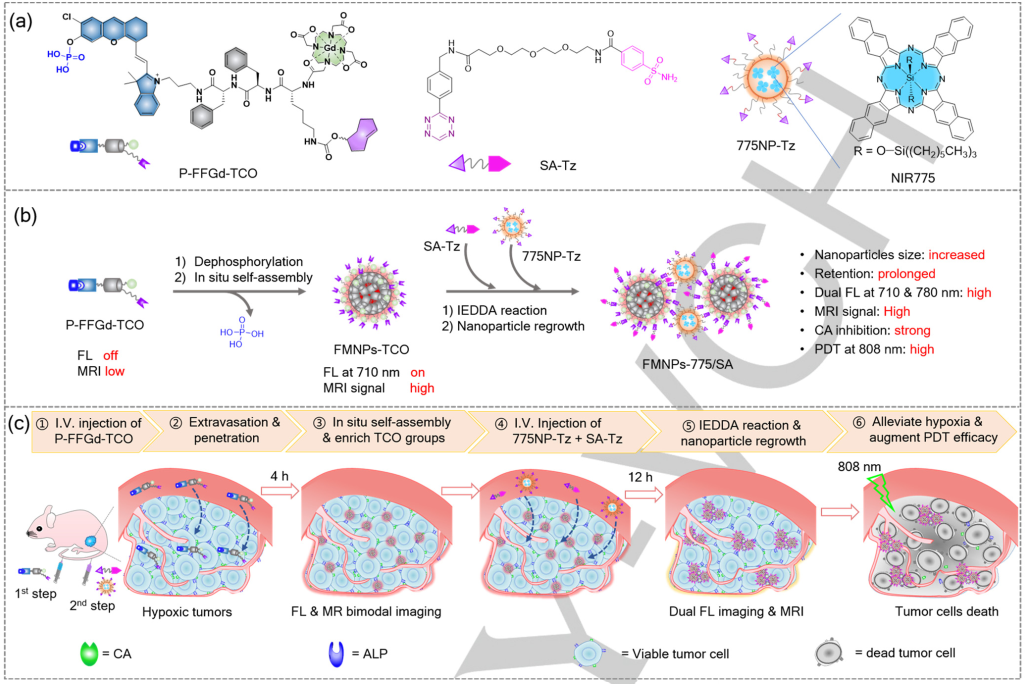
南京大學葉德舉教授開發了一種基于堿性磷酸酶(ALP)介導的級聯原位自組裝和生物正交逆電子需求的狄爾斯-阿爾德(IEDDA)反應的腫瘤預靶向診療方法,以實現多模態成像指導的協同PDT。
本文要點:
(1)具有酶催化作用的ALP能夠連續催化含反式環辛烯(TCO)的P-FFGd-TCO發生去磷酸化和自組裝,以原位合成具有熒光和磁性、含TCO的納米顆粒(FMNPs-TCO),并保留在腫瘤細胞膜上。研究發現,FMNPs-TCO可以作為“人工抗原”,其能夠通過快速的IEDDA反應同時捕獲四嗪(Tz)修飾的PS(775NP-Tz)和碳酸酐酶(CA)抑制劑(SA-Tz)。
(2)生物掃描電鏡和熒光成像分析結果表明,這兩步預靶向過程可以進一步誘導FMNPs-TCO直接在腫瘤細胞膜上生成微粒(FMNPs-775/SA)。因此,該策略可以實現SA-Tz和775NP-Tz在腫瘤中的高效富集,從而通過持續抑制CA活性來緩解乏氧,以提高PDT的療效。實驗結果表明,經808 nm激光(0.33 W cm-2, 10 min)照射后,裸鼠皮下HeLa腫瘤可被完全清除,且不會造成腫瘤復發。綜上所述,該研究設計的預靶向方法能夠被進一步拓展用于其他的腫瘤治療藥物,以提高靶向治療的效果。
Xidan Wen. et al. Cascade In Situ Self-Assembly and Bioorthogonal Reaction Enable the Enrichment of Photosensitizers and Carbonic Anhydrase Inhibitors for Pretargeted Cancer Theranostics. Angewandte Chemie International Edition. 2023
DOI: 10.1002/anie.202314039
https://onlinelibrary.wiley.com/doi/10.1002/anie.202314039




















