線粒體活性氧簇(Mitochondrial reactive oxygen species,mROS)會在骨關節炎(osteoarthritis,OA)的發病過程中發揮重要作用,有望成為OA治療的新靶點。有鑒于此,廣西醫科大學第一附屬醫院鄭立教授、趙勁民教授和Nihan Lan構建了一種靶向線粒體新型SOD模擬物Mn3O4@PDA@Pd-SS31納米酶,其具有近紅外(NIR)響應性和協同級聯清除mROS的性能,可用于治療OA。
本文要點:
(1)研究發現,NIR光照射會加速納米酶釋放Pd和Mn3O4,以增強SOD和CAT模擬酶的活性,逆轉線粒體功能障礙,促進線粒體自噬,進而有效清除軟骨細胞中的mROS,調節氧化應激微環境,最終實現對炎癥反應的抑制。
(2)實驗結果表明,該納米酶可通過腸道代謝途徑被排出體外,且具有良好的生物相容性,能夠有效減輕炎癥反應,緩解OA關節軟骨退變,治療4周和8周的OARSCI評分分別降低93.7%和93.8%。綜上所述,該研究構建的靶向線粒體的NIR響應性Mn3O4@PDA@Pd-SS31納米酶可以有效清除mROS,修復受損的線粒體功能,促進軟骨再生,有望用于OA的臨床治療。
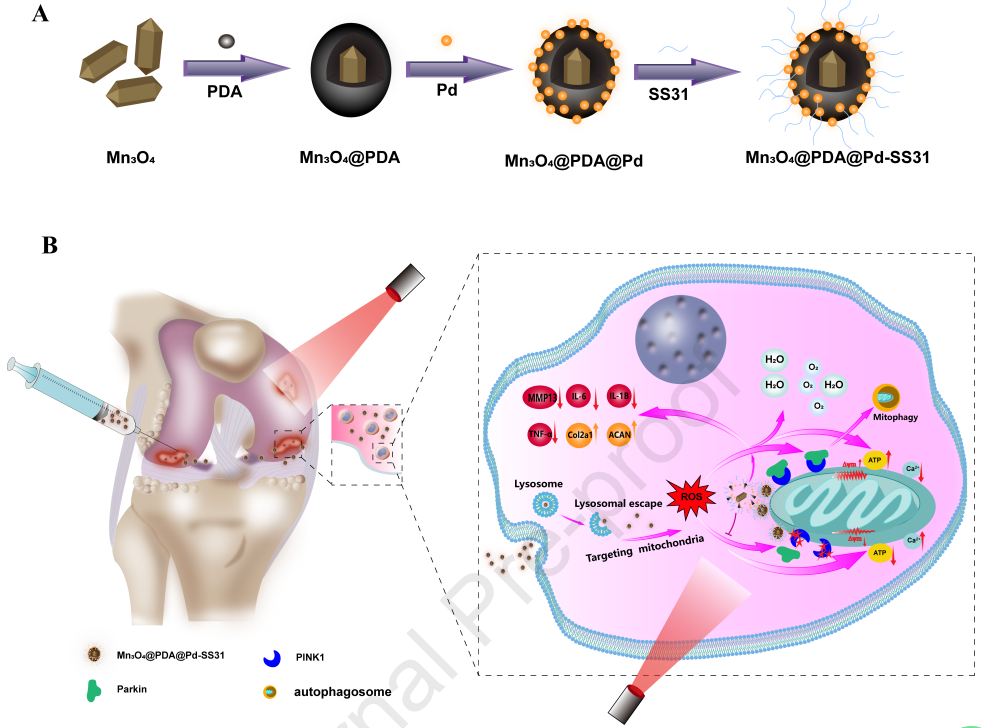
Yuquan Li. et al. Mitochondrial-targeting and NIR-responsive Mn3O4@PDA@Pd-SS31 nanozymes reduce oxidative stress and reverse mitochondrial dysfunction to alleviate osteoarthritis. Biomaterials. 2023
https://www.sciencedirect.com/science/article/pii/S014296122300457X



















