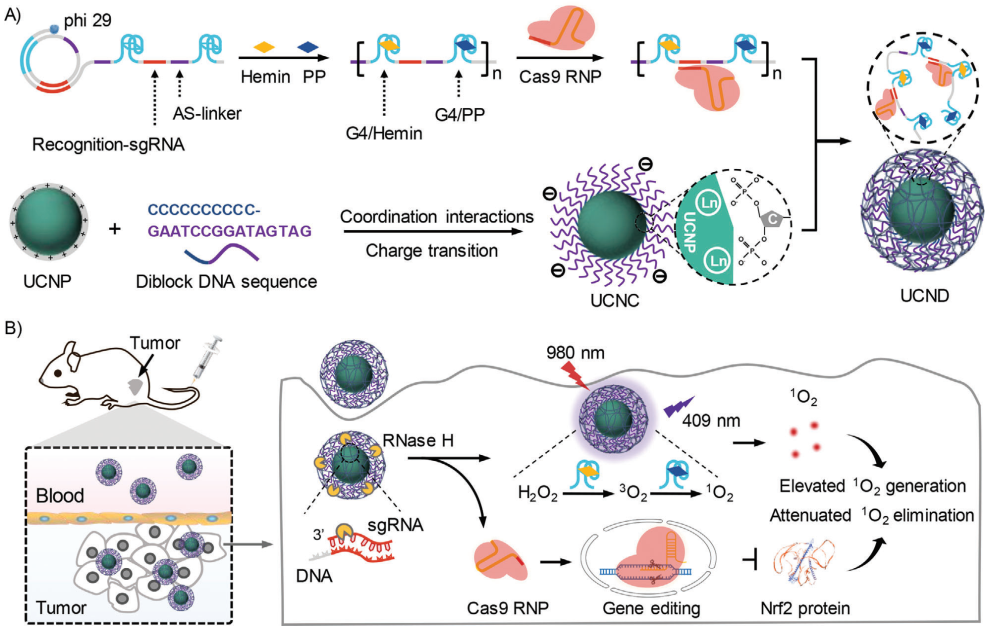
光動力療法(PDT)需要通過光照射激發(fā)光敏劑(PS)以產(chǎn)生活性氧(ROS),其在腫瘤微環(huán)境乏氧、癌細胞的抗氧化反應(yīng)以及光對組織的穿透性有限等方面仍面臨著嚴峻的挑戰(zhàn)。有鑒于此,天津大學姚池教授、仰大勇教授和上海交通大學劉培峰教授開發(fā)了一種多功能DNA/上轉(zhuǎn)換納米顆粒(UCNPs)復合物,該復合物能夠可控地共遞送CRISPR-Cas9、血紅素和原卟啉(PP),以實現(xiàn)協(xié)同PDT。
本文要點:
(1)實驗通過滾環(huán)擴增(RCA)技術(shù)制備了超長單鏈DNA(ssDNA),其中包含用于負載Cas9核糖核蛋白(RNP)的單向?qū)NA(sgRNA)識別序列、用于負載hemin和PP的G-四聯(lián)體序列以及用于結(jié)合UCNP的連接序列。研究發(fā)現(xiàn),Cas9 RNP能夠切割抗氧化調(diào)節(jié)器核因子E2相關(guān)因子2(Nrf2),提高癌細胞對ROS的敏感性,從而增強協(xié)同PDT效應(yīng)。
(2)G-四聯(lián)體/血紅素DNA酶能夠模擬辣根過氧化物酶(HRP)活性,催化內(nèi)源性H2O2轉(zhuǎn)化為O2,以克服腫瘤的乏氧微環(huán)境。此外,引入的UCNP也能夠?qū)⒋┩干顚咏M織的近紅外光轉(zhuǎn)換為波長較短的光,從而激發(fā)PP將豐富的O2轉(zhuǎn)化為1O2。基因編輯和PDT的聯(lián)合作用能夠使得癌細胞中大量積累1O2,從而顯著增強癌細胞凋亡。實驗結(jié)果表明,該研究設(shè)計的協(xié)同PDT策略能夠在乳腺癌小鼠模型中表現(xiàn)出顯著的治療效果。
Nachuan Song. et al. A DNA/Upconversion Nanoparticle Complex Enables Controlled Co-Delivery of CRISPR-Cas9 and Photodynamic Agents for Synergistic Cancer Therapy. Advanced Materials. 2024
DOI: 10.1002/adma.202309534
https://onlinelibrary.wiley.com/doi/10.1002/adma.202309534



















