合理的結構設計有助于開發高效的納米平臺以用于腫瘤診療。有鑒于此,山東第一醫科大學(山東省醫學科學院)孫曉教授、董建教授和Hui Liu制備了一種多功能聚多巴胺(PDA)包被的硫化錳(MnS)納米團簇。
本文要點:
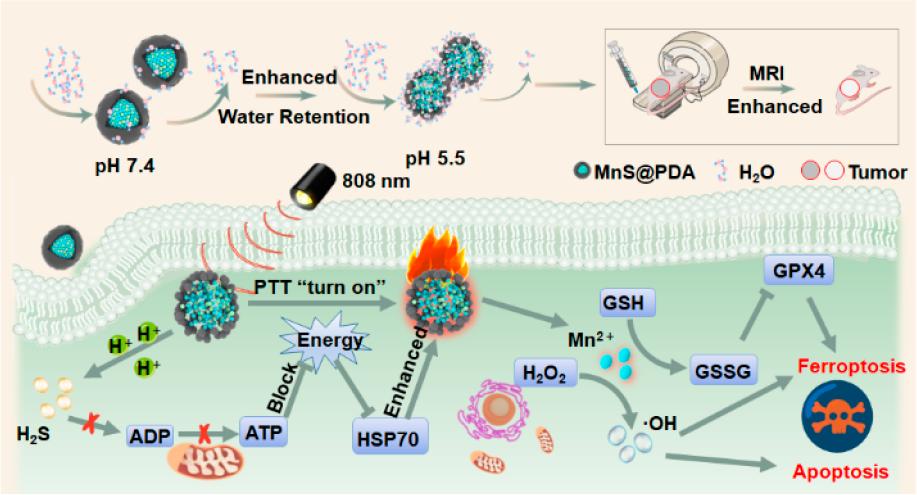
(1)PDA的多羥基結構可通過氫鍵增強水與pH響應性MnS納米團簇的相互作用。包覆PDA后,MnS納米團簇的自旋-晶格弛豫率會從5.76 mM?1·s?1顯著提高至19.33 mM?1·s?1(在pH 5.5的條件下),從而能夠實現高效的腫瘤磁共振成像。此外,PDA也會使得該MnS納米團簇具有優異的生物相容性和良好的光熱轉換效率,可用于實現高效的腫瘤光熱治療(PTT)。
(2)研究發現,MnS納米團簇具有在酸性的腫瘤微環境中釋放H2S的能力,因此能夠有效地抑制線粒體呼吸和三磷酸腺苷的產生,導致熱休克蛋白的表達明顯減少,以降低腫瘤細胞對光熱刺激的抵抗力,從而增強PTT的療效。實驗結果表明,釋放的Mn2+還能夠表現出高效的過氧化物酶和類谷胱甘肽氧化酶等活性,可以有效誘導腫瘤細胞發生鐵死亡和細胞凋亡。綜上所述,該研究開發的納米平臺是一種能夠增強磁共振成像對比和實現協同的腫瘤鐵死亡-PTT的納米治療藥物。
Guiqi Ma. et al. Polydopamine Nanostructure-Enhanced Water Interaction with pH-Responsive Manganese Sulfide Nanoclusters for Tumor Magnetic Resonance Contrast Enhancement and Synergistic Ferroptosis?Photothermal Therapy. ACS Nano. 2024
DOI: 10.1021/acsnano.3c10249
https://pubs.acs.org/doi/10.1021/acsnano.3c10249



















