
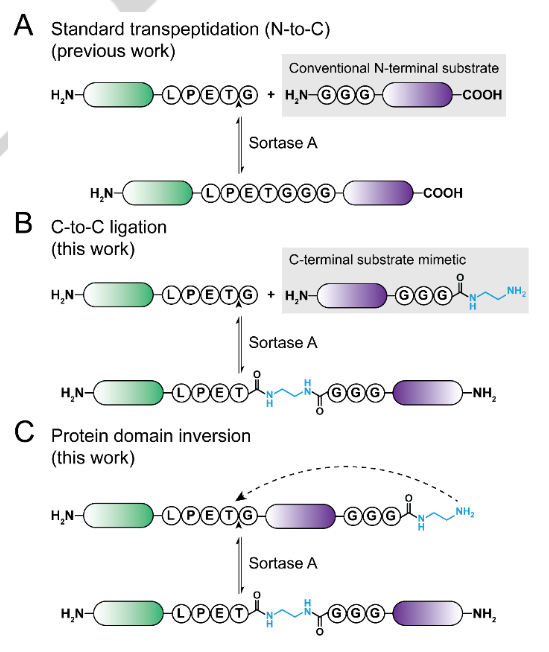
蛋白質(zhì)的拓?fù)滢D(zhuǎn)換和排列作為產(chǎn)生新的蛋白質(zhì)功能或穩(wěn)定性的策略引起了人們的極大興趣。這些努力主要受到自然發(fā)生的翻譯后修飾的啟發(fā),如頭尾環(huán)化、環(huán)狀排列或套索狀纏結(jié)。在環(huán)狀排列的情況下,可以通過(guò)遺傳編碼來(lái)促進(jìn)這種方法,或者在環(huán)化的情況下,可以通過(guò)酶處理來(lái)促進(jìn)這種方法。值得注意的是,這些先前描述的策略沒(méi)有改變多肽主鏈的方向。
昆士蘭大學(xué)Fabian B. H. Rehm等描述了一種非天然的蛋白質(zhì)排列,即蛋白質(zhì)結(jié)構(gòu)域倒位。
本文要點(diǎn):
(1)
由此蛋白質(zhì)的C-末端部分相對(duì)于蛋白質(zhì)的N-末端部分從標(biāo)準(zhǔn)的N-to-C酶促倒位為C-to-C構(gòu)型。概念上最相似的生物學(xué)過(guò)程可能是重組酶催化的DNA片段的倒置。作者使用一種工程化的分類(lèi)酶A實(shí)現(xiàn)了這些逆轉(zhuǎn),這是一種廣泛使用的轉(zhuǎn)肽酶。
(2)
作者的反應(yīng)在4-25°C的溫和條件下有效進(jìn)行,并且與完全異源產(chǎn)生的蛋白質(zhì)底物兼容。
參考文獻(xiàn):
Yan Zhou, Thomas Durek, David J. Craik, Fabian B. H. Rehm, Sortase-Catalyzed Protein Domain Inversion,Angew. Chem. Int. Ed. 2024, e202316777.
DOI: 10.1002/anie.202316777
https://doi.org/10.1002/anie.202316777


















