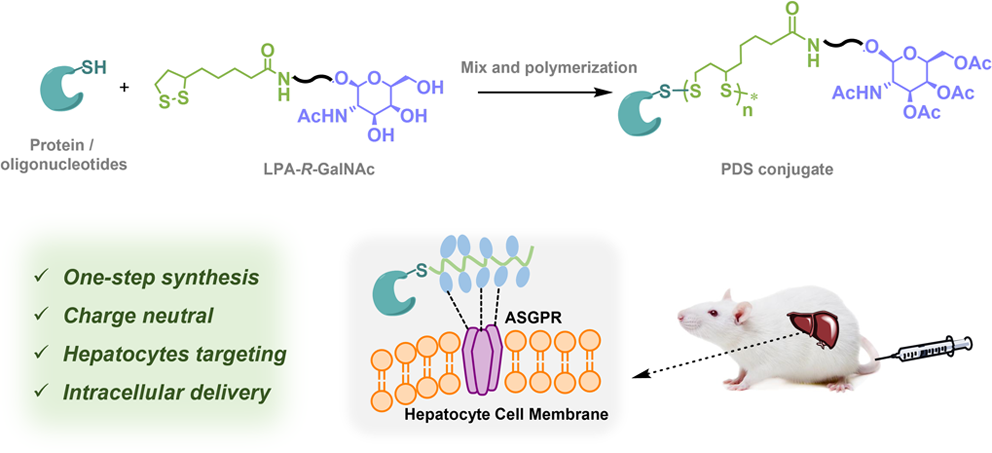
通過全身給藥實現生物制劑(包括蛋白質和反義寡核苷酸(ASO))在特定器官或細胞內的胞內遞送是一項亟待攻克的難題。有鑒于此,北京大學呂華研究員利用N-乙酰化半乳糖胺(GalNAc)功能化、細胞穿透性聚二硫化物(PDSs)偶聯物設計了一種能夠在體外和體內將蛋白質和ASO遞送到肝細胞的新方法。
本文要點:
(1)含硫醇的載荷可通過聚集誘導聚合實現GalNAc功能化的硫辛酰胺單體的開環聚合,從而形成準均勻分散的位點特異性蛋白/ASO-PDS偶聯物。研究發現,該偶聯物的肝細胞選擇性胞內遞送功能是多種因素共同作用的結果。其中,GalNAc會首先與肝細胞上的ASGPR受體結合,從而導致細胞固定化。隨后,在細胞表面發生的硫醇-二硫鍵交換能夠促進細胞內化。
(2)實驗結果表明,PDS骨架與細胞表面之間的緊密距離具有非常重要的作用,其能夠決定硫醇-二硫鍵交換的成功,從而影響細胞穿透。綜上所述,該研究構建的偶聯物有望能夠克服全身和細胞特異性生物大分子物質遞送過程中遇到的多種生物障礙,從而為一系列設計靶向肝臟疾病的診療策略開辟了新的途徑。
Jianhua Lu. et al. Organ/Cell-Selective Intracellular Delivery of Biologics via N?Acetylated Galactosamine-Functionalized Polydisulfide Conjugates. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.3c11914
https://pubs.acs.org/doi/10.1021/jacs.3c11914



















