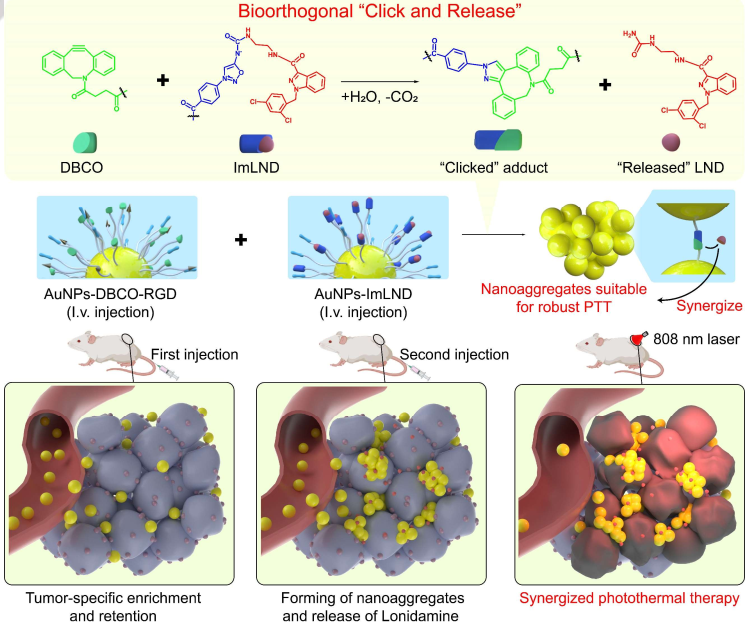
癌癥是最致命的疾病之一。據(jù)估計(jì),到2030年,每年將有1300萬人死于癌癥。基于金納米粒子(AuNPs)的光熱治療(PTT)因其高度的時(shí)空可控性和無創(chuàng)性引起了研究者的極大關(guān)注。由于AuNPs的粒徑和光熱效率之間存在相關(guān)性,因此需要通過合理的設(shè)計(jì)策略來將AuNPs聚集成更大的粒子,使其在腫瘤部位產(chǎn)生理想的近紅外吸收。有鑒于此,武漢大學(xué)張先正教授和劉傳軍教授利用iminosydnone和環(huán)炔之間的生物正交“點(diǎn)擊釋放”(BCR)反應(yīng)實(shí)現(xiàn)了金納米粒子的聚集和化療藥物的伴隨釋放,以實(shí)現(xiàn)協(xié)同的光熱治療。
本文要點(diǎn):
(1)實(shí)驗(yàn)合成了iminosydnone-氯尼達(dá)明(ImLND)前藥,并選擇二苯并環(huán)辛炔(DBCO)作為BCR反應(yīng)的觸發(fā)劑。隨后,研究者設(shè)計(jì)了一種基于聚乙二醇化金納米粒子的雙組分納米平臺(tái),其由負(fù)載前藥的金納米粒子-ImLND和腫瘤靶向肽RGD偶聯(lián)的金納米粒子-DBCO-RGD組成。
(2)在治療過程中,被靜脈注射的AuNPs-DBCO-RGD能夠在腫瘤中實(shí)現(xiàn)特異性富集和保留。當(dāng)注射的金納米粒子-ImLND到達(dá)腫瘤部位后,ImLND和DBCO之間的BCR反應(yīng)有助于形成具有高度光熱活性的金納米粒子聚集體。與此同時(shí),釋放的氯尼達(dá)明也可通過增強(qiáng)癌細(xì)胞對PTT的敏感性以進(jìn)一步提高腫瘤光熱治療的效果。
Xiao Yan. et al. Bioorthogonal “Click and Release” Reaction-Triggered Aggregation of Gold Nanoparticles Combined with Released Lonidamine for Enhanced Cancer Photothermal Therapy. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202318539
https://onlinelibrary.wiley.com/doi/10.1002/anie.202318539



















