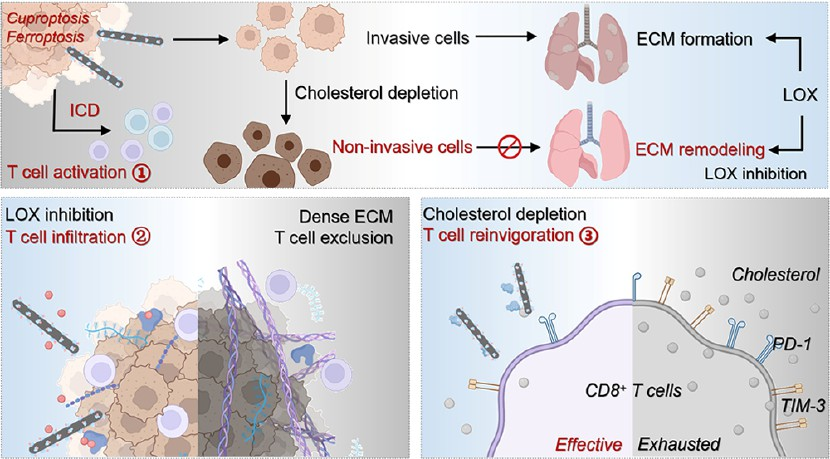
腫瘤微環境(TME)中的細胞外基質(ECM)和抗腫瘤免疫細胞的免疫檢查點(ICs)上調會阻礙T細胞的浸潤和殺傷作用,從而形成免疫抑制性TME。有鑒于此,南洋理工大學趙彥利教授、中國科學院長春應化所張洪杰院士和王櫻蕙研究員開發了一種共遞送膽固醇氧化酶(CHO)和賴氨酰氧化酶抑制劑(LOX-IN-3)的單位點納米酶(Cu-DBCO/CL)。
本文要點:
(1)共軛的有機配體和分布均勻的Cu-O4位點使得Cu-DBCO具有獨特的氧化還原性能,其能夠催化O2和H2O2生成·O2?和·OH。活性氧物種(ROS)的激增會導致線粒體功能受損和ATP供應不足,進而影響銅轉運ATP酶-1的功能,并引起由二氫硫辛酰胺S-乙酰轉移酶寡聚化介導的銅死亡。研究發現,ROS風暴和谷胱甘肽過氧化物酶4耗竭也可誘導脂質過氧化,并觸發鐵死亡。與此同時,ROS觸發釋放的LOX-IN-3可通過抑制賴氨酰氧化酶活性重塑ECM,進一步增強細胞毒性T淋巴細胞(CD8+ T細胞)的浸潤。
(2)CHO觸發的膽固醇消耗不僅會增加·OH的生成,還能夠下調ICs(如PD-1和TIM-3)的表達,以恢復腫瘤浸潤CD8+ T細胞的抗腫瘤活性。實驗結果表明,Cu-DBCO/CL可級聯增強CD8+ T細胞的活性,有效地激活抗腫瘤免疫反應。與此同時,ECM重塑和膽固醇消耗也有助于抑制腫瘤細胞的轉移和增殖。綜上所述,該研究設計的免疫納米重塑器可通過增強腫瘤免疫原性、重塑ECM和下調ICs等機制顯著地增強T細胞的浸潤和抗腫瘤活性,從而有效地抑制腫瘤的生長和轉移。
Yang Liu. et al. Single-Site Nanozymes with a Highly Conjugated Coordination Structure for Antitumor Immunotherapy via Cuproptosis and Cascade-Enhanced T Lymphocyte Activity. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.3c08622
https://pubs.acs.org/doi/10.1021/jacs.3c08622



















