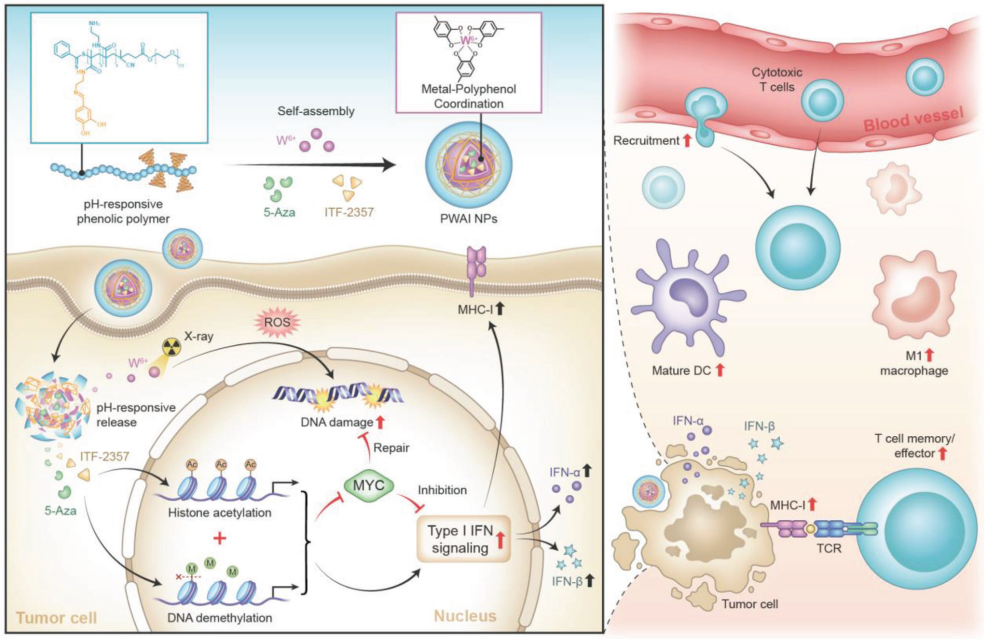
癌細(xì)胞可通過上調(diào)MYC的表達(dá)來修復(fù)放療引發(fā)的DNA損傷,進(jìn)而加重治療耐藥性和腫瘤免疫抑制。以MYC轉(zhuǎn)錄異常為靶點(diǎn)的表觀遺傳學(xué)治療有望能夠解決這一臨床問題。有鑒于此,澳門大學(xué)代云路教授和李蓓教授將5-Aza(DNA甲基轉(zhuǎn)移酶抑制劑)和ITF-2357(組蛋白去乙酰化酶抑制劑)設(shè)計(jì)成鎢基納米放療增敏劑(PWAI),以抑制MYC的上調(diào),從而誘導(dǎo)產(chǎn)生強(qiáng)大的放療抗腫瘤免疫。
本文要點(diǎn):
(1)單獨(dú)的5-Aza能夠減少M(fèi)YC的表達(dá),但無法有效喚醒放療免疫。而引入的ITF-2357則可以觸發(fā)癌細(xì)胞I型干擾素(IFN-I)信號傳導(dǎo),從而克服這一缺陷。研究發(fā)現(xiàn),5-Aza與ITF-2357的偶聯(lián)能夠確保PWAI在增強(qiáng)放射治療腫瘤殺傷作用的同時(shí)不會引起與MYC相關(guān)的高度免疫抵抗,并且能夠促進(jìn)IFN-I信號相關(guān)蛋白(IFN-α和IFN-β)的產(chǎn)生。
(2)與單純放療不同的是,PWAI誘導(dǎo)的免疫-放射治療可以顯著增強(qiáng)4T1荷瘤小鼠體內(nèi)樹突狀細(xì)胞的腫瘤抗原提呈,并促進(jìn)腫瘤內(nèi)細(xì)胞毒性T淋巴細(xì)胞的募集及其記憶表型的形成。綜上所述,該研究證明了雙重表觀遺傳重編程策略能夠降低放療誘導(dǎo)的MYC過表達(dá),進(jìn)而可以實(shí)現(xiàn)良好的免疫-放射治療效果。
Guohao Wang. et al. Dual-Epigenetically Relieving the MYC-Correlated Immunosuppression via an Advanced Nano-Radiosensitizer Potentiates Cancer Immuno-Radiotherapy. Advanced Materials. 2024
DOI: 10.1002/adma.202312588
https://onlinelibrary.wiley.com/doi/10.1002/adma.202312588




















