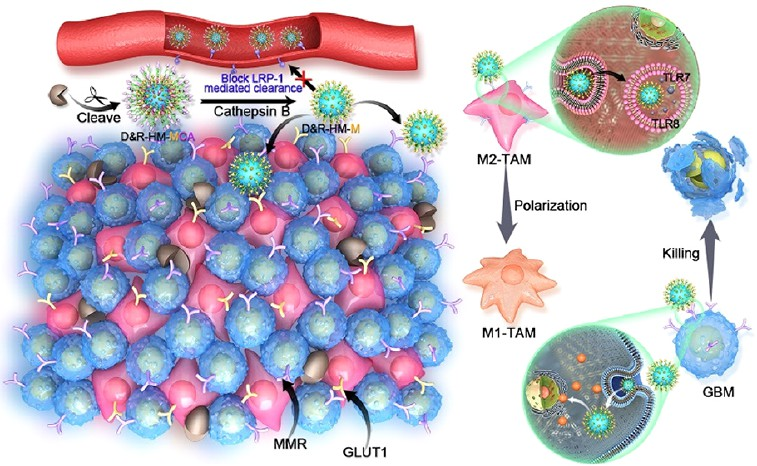
腫瘤相關巨噬細胞(TAMs)與多形性膠質母細胞瘤(GBM)的進展及其對常規化療的耐藥性密切相關。TAMs靶向治療聯合常規化療有望成為治療GBM的新策略。然而,血腦屏障(BBB)仍會嚴重限制該治療策略的效果。此外,區分不同靶細胞的能力的缺乏也是實現精準治療所面臨的一項嚴峻挑戰。有鑒于此,北京理工大學阮少波教授、黃淵余教授和四川大學高會樂教授構建了一種對組織蛋白酶B(CTSB)響應的程序性腦靶向遞送系統(D&R-HM-MCA),并將其用于同時靶向TAMs和GBM。
本文要點:
(1)D&R-HMMCA可通過低密度脂蛋白受體相關蛋白1(LRP1)介導的跨細胞作用穿過BBB。在到達GBM部位后,外部的angiopep-2修飾可通過CTSB響應肽的裂解而從D&R-HM-MCA中分離,從而能夠避免由LRP1介導的外排。研究發現,暴露的p-氨基苯基-α-D-吡喃甘露糖苷(MAN)修飾可進一步識別GBM上的葡萄糖轉運蛋白1(GLUT1)和TAMs上的巨噬細胞甘露糖受體(MMR)。
(2)D&R-HM-MCA在實現化療殺傷GBM的同時,也可誘導TAM發生從抗炎M2表型向促炎M1表型的極化,從而增強化療,并改善抗GBM的免疫反應。實驗結果表明,該CTSB響應性腦靶向遞送系統不僅可以提高對大腦的遞送效率,而且能夠實現靶向GBM的化學-免疫聯合治療。綜上所述,該研究設計的策略有望為構建具有多功能性的腦靶向遞送系統和高效的治療方案提供新的思路。
Shaoping Jiang. et al. Cathepsin B?Responsive Programmed Brain Targeted Delivery System for ChemoImmunotherapy Combination Therapy of Glioblastoma. ACS Nano. 2024
DOI: 10.1021/acsnano.3c11958
https://pubs.acs.org/doi/10.1021/acsnano.3c11958



















