
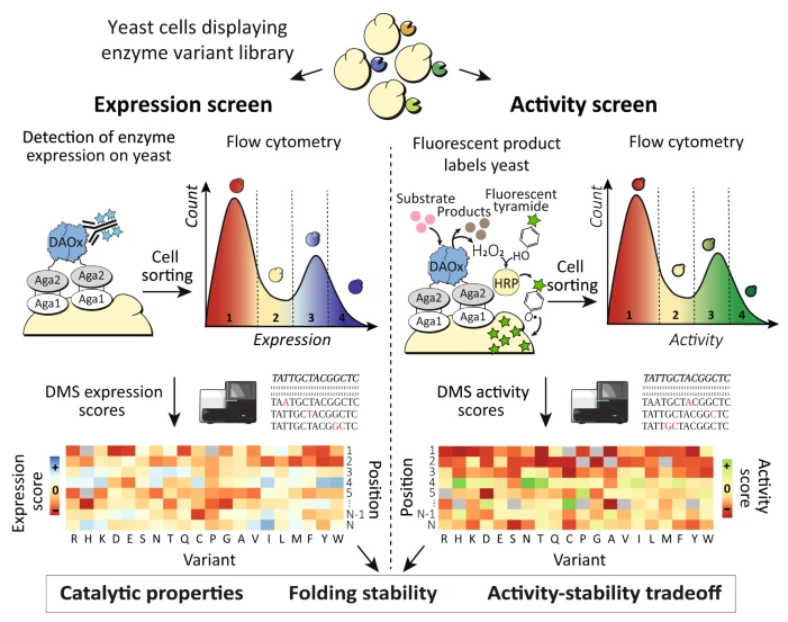
理解酶序列、折疊穩定性和催化活性之間的復雜關系對于工業和生物醫學應用至關重要。然而,目前的酶分析技術受限于無法同時解析穩定性和活性表型,以及無法將這些表型與大規模的基因序列相結合。
巴塞爾大學Michael A. Nash和Rosario Vanella等介紹了酶鄰近測序的發展,這是一種深度突變掃描方法,利用過氧化物酶介導的單細胞保真自由基標記來剖析單個實驗中數千種突變對氧化還原酶穩定性和催化活性的影響。
本文要點:
(1)
作者使用酶鄰近測序來分析6399個錯義突變如何影響纖細紅酵母D-氨基酸氧化酶的折疊穩定性和催化活性。由此產生的數據集證明了在自然進化過程中限制折疊穩定性的基于活性的約束,并確定了遠離活性位點的熱點作為突變的候選,這些突變在不犧牲穩定性的情況下提高了催化活性。
(2)
酶鄰近測序可以擴展到其他酶類,并為控制酶結構和功能的生物物理原理提供有價值的見解。
參考文獻:
Vanella, R., Küng, C., Schoepfer, A.A. et al. Understanding activity-stability tradeoffs in biocatalysts by enzyme proximity sequencing. Nat Commun 15, 1807 (2024).
DOI: 10.1038/s41467-024-45630-3
https://doi.org/10.1038/s41467-024-45630-3


















