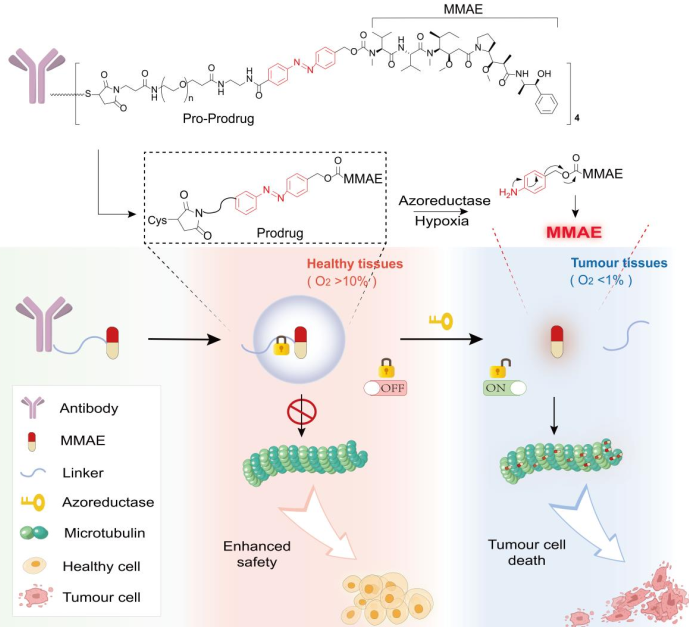
一旦抗體-藥物偶聯(lián)物(ADC)進(jìn)入細(xì)胞內(nèi),現(xiàn)有的ADC連接子(無論是可裂解的連接子還是不可裂解的連接子)即可釋放劇毒的有效載荷或有效載荷衍生物。然而,臨床研究表明,只有1%的ADC會(huì)在腫瘤細(xì)胞內(nèi)蓄積,而其余99%的ADC則會(huì)非特異性地分布于健康組織和細(xì)胞中,因此將不可避免地導(dǎo)致脫靶毒性。有鑒于此,北京藥理毒理研究所周辛波研究員、鐘武研究員和中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院鄧洪斌研究員設(shè)計(jì)了一種智能的腫瘤特異性連接子策略,即通過引入乏氧激活的偶氮苯基團(tuán)作為毒性控制器來構(gòu)建腫瘤特異性連接子。
本文要點(diǎn):
(1)研究發(fā)現(xiàn),這種基于偶氮苯的連接子在健康組織中(O2>10%)是不可裂解的,而相應(yīng)的有效載荷衍生物(氨基酸附加半胱氨酸(Cys)-偶氮苯連接體-一甲基澳瑞他汀E(MMAE))則可以作為一種安全的前藥來掩蓋MMAE的毒性(關(guān)閉)。研究發(fā)現(xiàn),當(dāng)暴露于乏氧的腫瘤微環(huán)境(O2<1%)時(shí),該連接子會(huì)被切割以釋放MMAE,并完全恢復(fù)ADC的高細(xì)胞毒性(打開)。
(2)實(shí)驗(yàn)結(jié)果表明,含偶氮苯連接子的ADC能夠在體內(nèi)表現(xiàn)出優(yōu)異的抗腫瘤效果。與傳統(tǒng)的含可裂解或不可裂解連接子的ADC相比,其具有更好的治療窗口。綜上所述,該研究設(shè)計(jì)的偶氮苯連接子有望為開發(fā)下一代ADC連接子提供新的思路。
Dian Xiao. et al. Azobenzene-based Linker Strategy for Selective Activation of Antibody-Drug Conjugates. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202310318
https://onlinelibrary.wiley.com/doi/10.1002/anie.202310318



















