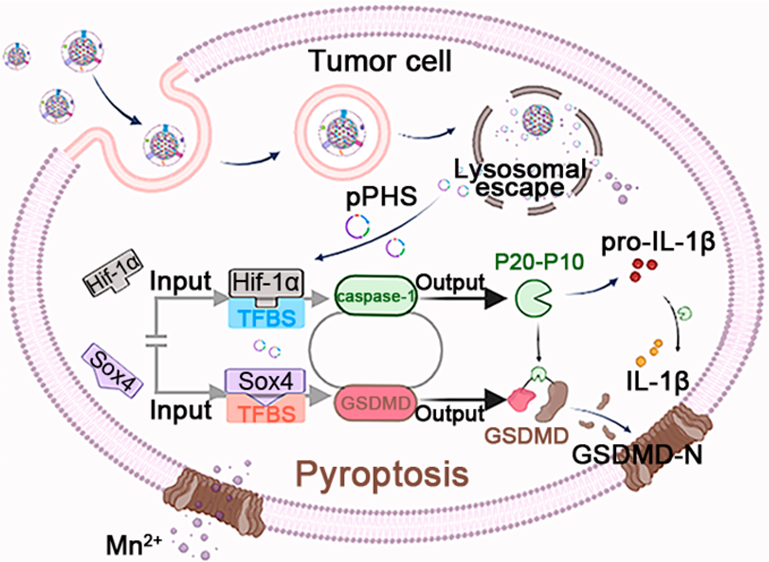
gasdermin蛋白介導的細胞焦亡在腫瘤免疫治療領域中具有巨大的應用潛力。然而,gasdermin蛋白低表達以及由非特異性細胞焦亡導致的全身毒性等問題仍會嚴重限制該策略的臨床應用。有鑒于此,鄭州大學陳真真教授和王永超研究員設計了一種合成生物學策略,將焦亡誘導質粒(pPHS)負載到錳(Mn)摻雜的碳酸鈣納米顆粒上,并包裹腫瘤源性細胞膜,構建了一種能夠誘導腫瘤特異性焦亡的納米平臺M-CNP/Mn@pPHS。
本文要點:
(1)M-CNP/Mn@pPHS具有良好的腫瘤靶向性。被腫瘤細胞內化后,MCNP/Mn@pPHS會在酸性內體環境中降解,使得質粒pPHS能夠有效地逃逸內體。研究發現,以Hif-1α和Sox4為兩個輸入信號、以gasdermin D誘導的細胞焦亡為輸出信號、根據“AND門電路”邏輯策略設計的pPHS能夠觸發腫瘤特異性細胞焦亡。只有在同時高表達Hif-1α和Sox4的細胞中,輸出信號gasdermin D才會被表達。
(2)由于Hif-1α和Sox4均在腫瘤細胞中特異性表達,因此M-CNP/Mn@pPHS能夠實現具有腫瘤特異性的gasdermin D表達,從而可引起細胞焦亡,觸發有效的免疫反應,并且不會產生顯著的全身毒性。實驗結果表明,該納米平臺釋放的Mn2+可通過刺激cGAS-STING通路進一步增強抗腫瘤免疫反應。因此,M-CNP/Mn@pPHS能夠有效地抑制腫瘤生長,實現體內腫瘤消退(79.8%)。綜上所述,該研究構建的基于邏輯“AND門電路”的gasdermin納米平臺能夠誘導腫瘤特異性細胞焦亡,并且具有極低的全身毒性。
Xiaoxi Wang. et al. Logic “AND Gate Circuit”-Based Gasdermin Protein Expressing Nanoplatform Induces Tumor-Specific Pyroptosis to Enhance Cancer Immunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.3c09405
https://pubs.acs.org/doi/10.1021/acsnano.3c09405



















